দ্রবণের ঘনমাত্রা ও দ্রাব্যতা আমাদের আজকের আলোচনার বিষয়। এই পাঠটি “এইচএসসি রসায়ন ১ম পত্র” এর “দ্রবণ ও দ্রাব্যতা” ইউনিট ৬ এর অন্তর্ভুক্ত।
Table of Contents
দ্রবণের ঘনমাত্রা ও দ্রাব্যতা
মোলার দ্রবণ :
নির্দিষ্ট তাপমাত্রায় দ্রবণের প্রতি লিটার আয়তনের মধ্যে কোন পদার্থের এক মোল বা গ্রাম আণবিক ভর পরিমাণ দ্রব দ্রবীভূত থাকলে ঐ দ্রবণকে ঐ দ্রবের মোলার দ্রবণ বলা হয়ে থাকে। মোলার দ্রবণের ঘনমাত্রাকে M দ্বারা প্রকাশ করা হয় এবং এর

মোলাল দ্রবণ :
1000 g দ্রাবকে কোনো দ্রবের এক গ্রাম অণু দ্রবীভূত থাকলে ঐ দ্রবণকে মোলাল দ্রবণ বলে। মোলাল দ্রবণকে m প্রতীক দ্বারা প্রকাশ করা হয়।
উদাহরণস্বরূপ : অনার্দ্র Na2CO3 এর গ্রাম আণবিক ভর 106 g.mol”। 1 লিটার বা 1000 mL পানিতে 106 g Na2CO3 দ্রবীভূত থাকলে, ক্ষার দ্রবণের মাত্রা 1 m। একইভাবে 98 g H,SO, বা 36.5 g HCl বা 40g NaOH কে 1000 mL পানিতে দ্রবীভূত করালে প্রস্তুতকৃত দ্রবণের মাত্রা 1 m।
নরমাল দ্রবণ :
1 L বা 1000 mL দ্রবণে 1 গ্রাম-তুল্য ভরের কোনো দ্রব দ্রবীভূত থাকলে, ঐ দ্রবণকে নরমাল দ্রবণ বলা হয়। নরমাল দ্রবণকে N প্রতীক দ্বারা প্রকাশ করা হয় । উদাহরণস্বরূপ : Na2CO3 এর গ্রাম-তুল্য ভর 53 g 53g Na2CO3 1000 mL দ্রবণে দ্রবীভূত থাকলে ঐ দ্রবণের মাত্রা 1 N H2SO4 এর গ্রাম তুল্য ভর 49 g। 49 g H, SO, 1000 mL দ্রবণে দ্রবীভূত থাকলে ঐ দ্রবণের মাত্রা 1 N
দ্রাব্যতা ( Solubility)
সাধারণত লবণসমূহ আয়নিক প্রকৃতির হওয়ায় পানিতে বিভিন্ন মাত্রায় দ্রবীভূত হয়। তাপমাত্রার পরিবর্তনে লবণসমূহের দ্রবীভূত হওয়ার হারও পরিবর্তিত হয় । নির্দিষ্ট তাপমাত্রায় নির্দিষ্ট পরিমাণ দ্রাবকে সকল পদার্থ একই পরিমাণে দ্রবীভূত হয় না । যেমন, 20° সে. তাপমাত্রায় 100 গ্রাম পানিতে KNO3 দ্রবীভূত হয় 31.6 গ্রাম অথচ একই তাপমাত্রায় ঐ একই পরিমাণ পানিতে CuSO4 দ্রবীভূত হয় 20.6 গ্রাম । দ্রাব্যতাকে নিম্নোক্তভাবে সংজ্ঞায়িত করা হয় :
“নির্দিষ্ট তাপমাত্রায় 100 গ্রাম দ্রাবকে সর্বোচ্চ যত গ্রাম দ্রব দ্রবীভূত হয়ে সম্পৃক্ত দ্রবণ তৈরি করে দ্রবের ঐ পরিমাণকে ঐ তাপমাত্রায় ঐ দ্রবের দ্রাব্যতা বলে।” দ্রাব্যতাকে মোল/লিটার এককে প্রকাশ করা হয়। দ্রাব্যতা দ্রাবকের প্রকৃতি, দ্রবের প্রকৃতি, তাপমাত্রা ও চাপের উপর নির্ভর করে
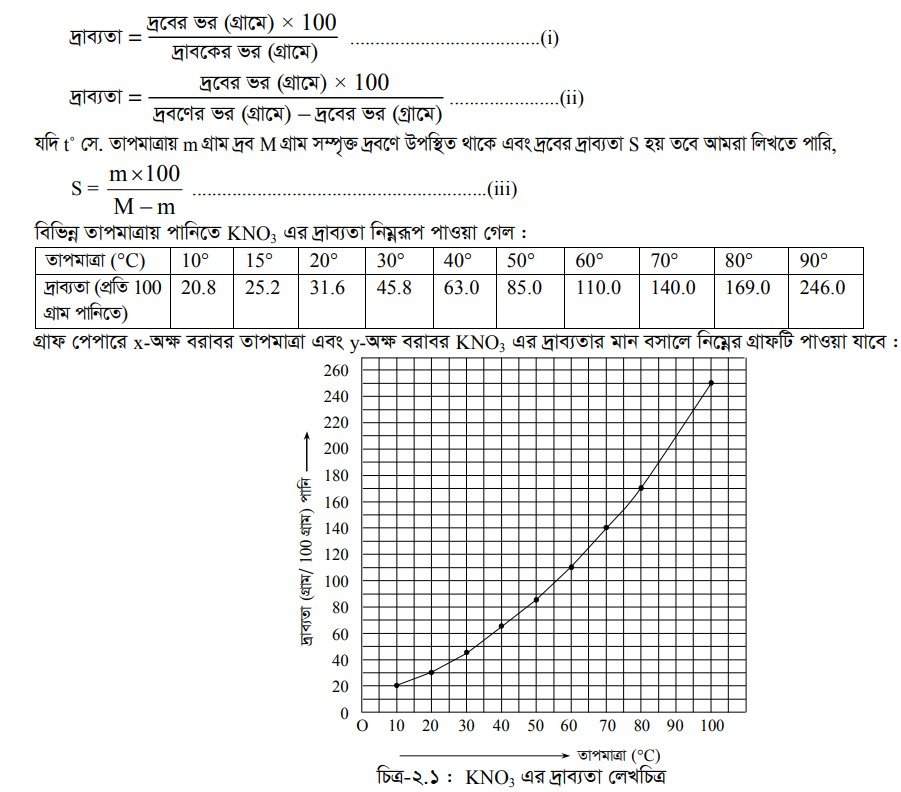
উক্ত গ্রাফ থেকে বলা যায় 55°C তাপমাত্রার KNO3 এর দ্রাব্যতা 100 এবং 85°C তাপমাত্রায় দ্রাব্যতা 180। দ্রাব্যতা গ্রাফ বিশ্লেষণ করলে দেখা যায় যে, তাপমাত্রা বৃদ্ধির সাথে সাথে পানিতে KNO3 এর দ্রাব্যতা বৃদ্ধি পেয়েছে এবং এ গ্রাফ থেকে যেকোনো তাপমাত্রায় পানিতে KNO3 এর দ্রাব্যতা নিরূপণ করা যায় ।
দ্রাব্যতার উপর তাপমাত্রার প্রভাব : কোনো বস্তুকে পানিতে দ্রবীভূত করার সময় যদি তাপের শোষণ ঘটে তবে -তাপমাত্রা বৃদ্ধিতে ঐ পদার্থের দ্রাব্যতা বৃদ্ধি পাবে। যেমন— KNO3, NaNO3, KI, Pb(NO3)2, AgNO3 ইত্যাদি। আবার বিপরীতভাবে, যদি তাপের উদ্ভব ঘটে তাহলে -তাপমাত্রা বৃদ্ধিতে দ্রাব্যতা হ্রাস ঘটবে। যেমন – Ca(NO3)2, Ca(OH)2, NaOH ইত্যাদি। বস্তু তাপ শোষণ বা বর্জন করবে তা নির্ভর করে দ্রবণ তাপের উপর । সোদক সালফেটের (Na2SO4. 10 H2O) এর দ্রাব্যতা -তাপমাত্রা বৃদ্ধির সাথে প্রথমে বৃদ্ধি পেলেও পরে হ্রাস পায়। 320-32-4°C পর্যন্ত দ্রাব্যতা বৃদ্ধি পায় এবং তার পর হ্রাস পায় ।
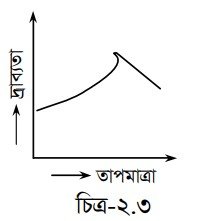
তাপমাত্রা বৃদ্ধিতে তাপ শোষণ করে কেলাস পানি বিয়োজিত হতে থাকে। এভাবে বিয়োজিত হতে হতে যখন সব পানি বিয়োজিত হয় তখন Na2SO4 তাপ বর্জন শুরু করে। ফলে -তাপমাত্রা বৃদ্ধিতে পরবর্তীতে দ্রাব্যতা হ্রাস পায়।
বিশুদ্ধ পানিতে AgCl লবণটির দ্রাব্যতা অপেক্ষা NaCl এর দ্রাব্যতা কম—
AgCl লবণটি স্বল্প মাত্রায় দ্রবণীয় লবণ।
দ্রবণে AgCl এর বিয়োজন সাম্য : AgCl (s) – Ag (aq) + CI (aq).
NaCl লবণটি অতিমাত্রায় দ্রবণীয় লবণ। জলীয় দ্রবণে এর সম্পূর্ণ বিয়োজন ঘটে।
NaCl(s) Na (aq) + CI (aq).
NaCl দ্রবীভূত হয়ে যে CI আয়ন উৎপন্ন করে এটি AgCl এর বিয়োজনে উৎপন্ন CI আয়নের সমআয়ন। NaCl দ্রবণে সমআয়ন CI আয়নের ঘনমাত্রা বেড়ে যাওয়ার কারণে AgCl এর দ্রাব্যতা গুণফল, Ksp এর মান একই রাখার জন্য Ag+ এর ঘনমাত্রা অবশ্যই কমাতে হবে। এ কারণে দ্রবণের কিছু Ag” আয়ন CI আয়নের সাথে যুক্ত হয়ে AgCl উৎপন্ন করবে। সুতরাং AgCl এর দ্রাব্যতা কমে যাবে।
পানিতে NH3 এর দ্রাব্যতা CO2 অপেক্ষা অধিক—
পানিতে NH3 এর দ্রাব্যতা CO2 অপেক্ষা অনেক অনেক গুণ বেশি। পানি (H2O) একটি পোলার অণু, অন্যদিকে NH3 অণুটিও পোলার। ফলে NH3 অণু অতি সহজে H2O অণুতে -দ্রবীভূত হতে পারে। NH3 গ্যাস যখন H2O অণুতে দ্রবীভূত হয় তখন NH3, H2O অণুর সাথে হাইড্রোজেন বন্ধন গঠন করে। উপরন্তু NH3 পানিতে -দ্রবীভূত হয়ে NH OH যৌগ উৎপন্ন করে। NH3 + H2O NH,OH. উৎপন্ন NH, OH এর বিয়োজন মাত্রা যথেষ্ট বেশি। এ কারণে পানিতে NH3 এর দ্রাব্যতা অধিক ।
এবার CO2 এর ক্ষেত্রে আসা যাক। পানি পোলার অণু হলেও CO2 অপোলার অণু। ফলে পানির অণুর সাথে CO2 হাইড্রোজেন বন্ধন গঠন করতে পারে না। CO2 অণু পানির সাথে বিক্রিয়া করে যে কার্বোনিক এসিড (H2CO3) অণু উৎপন্ন করে তার বিয়োজন মাত্রা NH OH অপেক্ষা অনেক কম। যে কারণে CO2 এর দ্রাব্যতা NH3 এর তুলনায় অনেক কম। বিপরীতভাবে NH3 এর দ্রাব্যতা CO2 অপেক্ষা অনেক বেশি।
পানিতে NH3 এর দ্রাব্যতা CO2 অপেক্ষা অধিক—
পানিতে NH3 এর দ্রাব্যতা CO2 অপেক্ষা অনেক অনেক গুণ বেশি। পানি (H2O) একটি পোলার অণু, অন্যদিকে NH3 অণুটিও পোলার। ফলে NH3 অণু অতি সহজে H2O অণুতে -দ্রবীভূত হতে পারে । NH3 গ্যাস যখন H2O অণুতে দ্রবীভূত হয় তখন NH3, H2O অণুর সাথে হাইড্রোজেন বন্ধন গঠন করে। উপরন্তু NH3 পানিতে দ্রবীভূত হয়ে NH,OH যৌগ উৎপন্ন করে । NH3 + H2O NH4OH. উৎপন্ন NH OH এর বিয়োজন মাত্রা যথেষ্ট বেশি। এ কারণে পানিতে NH3 এর দ্রাব্যতা অধিক ।
এবার CO2 এর ক্ষেত্রে আসা যাক। পানি পোলার অণু হলেও CO2 অপোলার অণু। ফলে পানির অণুর সাথে CO2 হাইড্রোজেন বন্ধন গঠন করতে পারে না। CO2 অণু পানির সাথে বিক্রিয়া করে যে কার্বোনিক এসিড (H2CO3) অণু উৎপন্ন করে তার বিয়োজন মাত্রা NH4OH অপেক্ষা অনেক কম। যে কারণে CO2 এর দ্রাব্যতা NH3 এর তুলনায় অনেক কম। বিপরীতভাবে NH3 এর দ্রাব্যতা CO2 অপেক্ষা অনেক বেশি।
সম্পৃক্ত NaCl থেকে বিশুদ্ধ NaCl প্রস্তুত করতে HCI গ্যাস চালনা করা হয়—
NaCl একটি শক্তিশালী তড়িৎ বিশ্লেষ্য। জলীয় দ্রবণে দ্রবীভূত হয়ে Na* আয়ন ও CI আয়ন উৎপন্ন করে ।
NaCl(s) _H,O(7) Na*(aq) + CT(aq).
NaCl এর জলীয় দ্রবণে এর চেয়ে বেশি দ্রাব্যতা গুণ সম্পন্ন HCl গ্যাস চালনা করলে HCI অতি সহজে ও দ্রুত দ্রবীভূত হয়ে H আয়ন ও CI আয়ন উৎপন্ন করে। পানিতে NaCl, HCl অপেক্ষা কম দ্রাব্যতা গুণ সম্পন্ন হওয়ায় সমআয়ন CI এর প্রভাবে Nat আয়ন ও CI আয়নের ঘনমাত্রার গুণফল NaCl এর দ্রাব্যতা গুণফলের মানকে অতিক্রম করে। ফলে দ্রবণের মধ্যে NaCl এর দ্রাব্যতা গুণফলকে ঠিক রাখার জন্য Na+ আয়ন ও CI আয়ন যুক্ত হয়ে অবিয়োজিত NaCl উৎপন্ন করে অধঃক্ষিপ্ত হয়।
দ্রাব্যতার প্রাথমিক ধারণা নিয়ে বিস্তারিত ঃ
দ্রাব্যতা – ১ ( দ্রাবক, দ্রব, দ্রবণ ) :
