দ্রবণ ও দ্রবণের প্রকারভেদ আমাদের আজকের আলোচনার বিষয়। এই পাঠটি “এইচএসসি রসায়ন ১ম পত্র” এর “দ্রবণ ও দ্রাব্যতা” ইউনিট ৬ এর অন্তর্ভুক্ত।
Table of Contents
দ্রবণ ও দ্রবণের প্রকারভেদ
দ্রবণ (Solution)
কঠিন, তরল বা গ্যাসীয় যেকোনো ভৌত অবস্থায় একাধিক উপাদানের সম্পূর্ণ সমসত্ত্ব মিশ্রণ, যাতে উপাদানগুলোর পরিমাণের অনুপাত একটি সীমার মধ্যে আবদ্ধ থাকে তাকে দ্রবণ বলা হয়। দ্রবণের প্রতিটি অংশের গঠন, ভৌত ও রাসায়নিক ধর্ম অভিন্ন হয় । দ্রবণের মধ্যে যে উপাদান কম পরিমাণে থাকে অর্থাৎ যা দ্রবীভূত হয়, তাকে দ্রব বলা হয়। দ্রবণের মধ্যে যে উপাদানের পরিমাণ বেশি এবং যার মধ্যে দ্রব যোগ করা হয় তাকে দ্রাবক বলা হয় ।
দ্রবণের প্রকারভেদ (Types of Solution )
দ্রব ও দ্রাবকের ভৌত অবস্থার উপর ভিত্তি করে বিভিন্ন প্রকারের দ্রবণ হয় ।
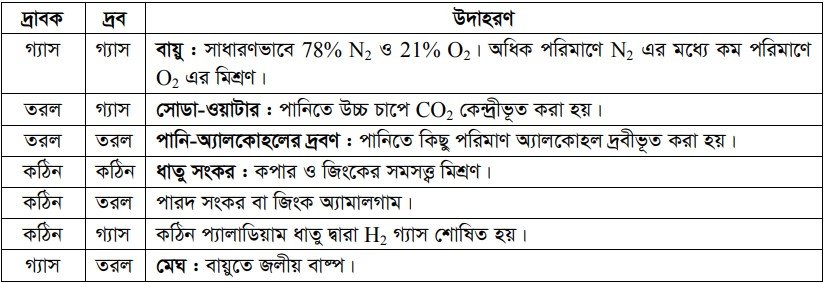
দ্রবণের শ্রেণিবিভাগ (Classification of Solution)
ঘনমাত্রা অনুযায়ী দ্রবণকে তিন ভাগে ভাগ করা হয়। যেমন—
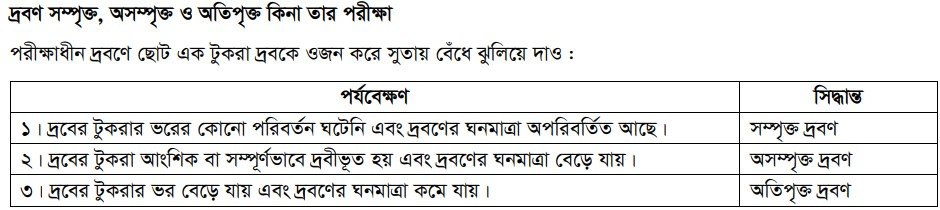
i. সম্পৃক্ত দ্রবণ (Saturated Solution) : কোনো নির্দিষ্ট তাপমাত্রায় নির্দিষ্ট পরিমাণ দ্রাবকে সর্বাধিক দ্রব দ্রবীভূত হয়ে যে দ্রবণ উৎপন্ন করে তাকে ঐ নির্দিষ্ট তাপমাত্রার সম্পৃক্ত দ্রবণ বলা হয়। এ অবস্থায় দ্রবণে অতিরিক্ত দ্রব যোগ করলেও দ্রবণের ঘনমাত্রার কোনো পরিবর্তন ঘটে না।
ii. অসম্পৃক্ত দ্রবণ (Unsaturated Solution) : কোনো নির্দিষ্ট তাপমাত্রায় নির্দিষ্ট পরিমাণ দ্রাবকে সর্বাধিক যে পরিমাণ দ্রব দ্রবীভূত হতে পারে তার চেয়ে কম পরিমাণ দ্রব দ্রবণে উপস্থিত থাকলে তাকে অসম্পৃক্ত দ্রবণ বলা হয়। অসম্পৃক্ত দ্রবণে অতিরিক্ত দ্রব যোগ করলে দ্রবণের ঘনমাত্রা বেড়ে যায়।
iii. অতিপৃক্ত দ্রবণ (Super-saturated Solution) : কোনো নির্দিষ্ট তাপমাত্রায় কোনো নির্দিষ্ট পরিমাণ দ্রাবকে সর্বাধিক যে পরিমাণ দ্রব দ্রবীভূত থাকতে পারে যদি কোনো বিশেষ কারণে দ্রবণে আরও অতিরিক্ত দ্রব দ্রবীভূত থাকে তবে ঐ দ্রবণকে অতিপৃক্ত দ্রবণ বলা হয়। অতিপৃক্ত দ্রবণ অস্থায়ী প্রকৃতির হয়।
দ্রবণ (Solution )
ভূমিকাতে এক গ্লাস পানিতে পরিমাণমতো চিনি দ্রবীভূত করে যে সমসত্ত্ব মিশ্রণ তৈরি করা হয়েছিল সেটিই মূলত দ্রবণ। অর্থাৎ পানিতে চিনির দ্রবণ। কোনো নির্দিষ্ট তাপমাত্রায় দুই বা ততোধিক কঠিন, তরল বা গ্যাসীয় পদার্থের সমসত্ত্ব মিশ্রণ, যার প্রতিটি উপাদানের আপেক্ষিক পরিমাণ একটি নির্দিষ্ট সীমা পর্যন্ত পরিবর্তিত করা যায়, তাকে দ্রবণ বলা হয় । দ্রবণের দুটি অংশ থাকে । একটি দ্রাবক অপরটি দ্রব। দ্রবণ = (দ্রাবক + দ্রব)।
দ্রাবক (Solvent)
দ্রাবক, দ্রবকে দ্রবীভূত করে। দ্রবণের মধ্যে যে উপাদানটি আপেক্ষিক পরিমাণে বেশি থাকে এবং যার ভৌত অবস্থা দ্রবণের ভৌত অবস্থাকে প্রকাশ করে তাকে দ্রাবক বলা হয় । উদাহরণ স্বরূপ : চিনির জলীয় দ্রবণের মধ্যে পানি দ্রাবক । তবে অনেক সময় দ্রবণের ভৌত অবস্থার উপর ভিত্তি করে কোন উপাদানটি দ্রাবক তা নিশ্চিতভাবে নির্ধারণ করা যায় না। দ্রবের ভৌত অবস্থা তরল এবং দ্রাবকের ভৌত অবস্থা তরল হলে সেক্ষেত্রে দ্রাবক ও দ্রবকে চিহ্নিত করা একটু অসুবিধাজনক হয় । দ্রবণের মধ্যে দ্রাবক ও দ্রবকে চিহ্নিত করার প্রচলিত রীতি হলো—
i. দ্রবণের ভৌত অবস্থা যে উপাদানটির বিশুদ্ধ অবস্থার অনুরূপ হয় এবং দ্রবণে যার আপেক্ষিক পরিমাণ অধিক থাকে, ঐ উপাদানটি হলো দ্রবণের দ্রাবক। যেমন— লবণ পানির জলীয় দ্রবণে পানি দ্রাবক এবং লবণ দ্রব, চিনি-পানির জলীয় দ্রবণে পানি দ্রাবক এবং চিনি দ্রব ।
ii. যদি এমনটি হয় যে, উপাদান দুটির ভৌত অবস্থাই দ্রবণের ভৌত অবস্থা তবে সেক্ষেত্রে দ্রবণে যে উপাদানটির আপেক্ষিক পরিমাণ অধিক সেটি হবে দ্রাবক । উদাহরণস্বরূপ : পানি ও ইথানলের দ্রবণে যদি ইথানলের পরিমাণ পানি অপেক্ষা অধিক হয় তবে ইথানল দ্রাবক এবং পানি দ্রব। আর যদি পানির পরিমাণ ইথানল অপেক্ষা অধিক হয় তবে পানি দ্রাবক এবং ইথানল দ্রব।
iii. উপাদান দুটির বিশুদ্ধ অবস্থা যদি দ্রবণের ভৌত অবস্থা হয় এবং দ্রবণের মধ্যে উপাদান দুটি যদি সমপরিমাণে থাকে তবে সেক্ষেত্রে দ্রবণের উপাদান দুটির যেকোনোটি দ্রাবক ধরে অপরটিকে দ্রব হিসেবে গণ্য করা হয় ।
দ্রব (Solute )
দুটি উপাদানের সমন্বয়ে উৎপন্ন দ্রবণে যে উপাদানটির আপেক্ষিক পরিমাণ কম থাকে এবং যে উপাদানটি অপর উপাদানের মধ্যে দ্রবীভূত থাকে তাকে দ্রব বলা হয়। খাদ্য লবণকে পানিতে দ্রবীভূত করে যে দ্রবণ প্রস্তুত করা হয় তাতে খাদ্য লবণ দ্রব। একইভাবে চিনির জলীয় দ্রবণে চিনি দ্রব ।
দ্রাবকের মধ্যে দ্রবের দ্রবীভূত হওয়ার ক্ষমতা অনুযায়ী দ্রবকে দুটি ভাগে ভাগ করা হয়। (i) স্বল্প দ্রবণীয় দ্রব এবং (ii) অতিমাত্রায় দ্রবণীয় দ্রব ।
i. স্বল্প দ্রবণীয় দ্রব : এ ধরনের দ্রব দ্রাবকের মধ্যে খুবই সামান্য পরিমাণে দ্রবীভূত হয়ে সম্পৃক্ত দ্রবণ উৎপন্ন করে। সাধারণ তাপমাত্রায় যেসব লবণের দ্রাব্যতা 0-01 গ্রাম অণু/লিটার বা 0.01 molL এর চেয়ে কম তাদের স্বল্প দ্রবণীয় দ্রব বলা হয়। সিলভার ক্লোরাইড (AgCl), সিলভার ব্রোমাইড (AgBr), সিলভার আয়োডাইড (AgI), সিলভার কার্বনেট (Ag2CO3), সিলভার ক্রোমেট (Ag2 CrO4), ক্যালসিয়াম কার্বনেট (CaCO3), ক্যালসিয়াম ফ্লোরাইড (CaF2), ক্যালসিয়াম সালফেট (CaSO4), ক্যালসিয়াম অক্সালেট (CaC2O4), ক্যালসিয়াম হাইড্রক্সাইড Ca(OH)2, লেড ক্লোরাইড (PbCh) ইত্যাদি স্বল্প দ্রবণীয় দ্রব ।
স্বল্প দ্রবণীয় দ্রবগুলো পানিতে প্রায় অদ্রবণীয় বলে মনে হয়। যে সামান্য পরিমাণ পানিতে দ্রবীভূত হয়ে সম্পৃক্ত দ্রবণ উৎপন্ন করে, সেই সম্পৃক্ত দ্রবণে লবণটি প্রায় সম্পূর্ণভাবে আয়নে বিয়োজিত হয়। সম্পৃক্ত দ্রবণে দ্রবীভূত আয়নগুলো অদ্রবণীয় কঠিন উপাদানের সাথে একটি সাম্যাবস্থা সৃষ্টি করে । উদাহরণস্বরূপ : স্বল্প দ্রবণীয় দ্রব AgCl এর ক্ষেত্রে—
AgCl(s) AgCl → Ag’ (aq) + CT (aq)
(অদ্রবীভূত অংশ) (দ্রবীভূত অংশ)
ii. অতিমাত্রায় দ্রবণীয় দ্রব : বেশ কিছু দ্রব আছে যারা পানিতে সম্পূর্ণভাবে দ্রবীভূত হয়ে যায়। এদের দ্রাব্যতা গুণ অনেক বেশি হওয়ায় এরা দ্রবণে সম্পূর্ণভাবে আয়নিত অবস্থায় থাকে। এ জাতীয় দ্রবের আণবিক অবস্থা ও আয়নিক অবস্থার মধ্যে কোনো সাম্যাবস্থা বিরাজ করে না। যেমন- NaCl, NaNO3, KCI, KNO3, NH CI, NH, NO, ইত্যাদি অতিমাত্রায় দ্রবণীয় দ্রব ।
দ্রবণের বৈশিষ্ট্য (Characteristics of Solution )
i. দ্রবণের মধ্যে দ্রবের অণু বা আয়নগুলো দ্রাবকের সাথে সমসত্ত্বভাবে অবস্থান করে ।
ii. দ্রবণে উপস্থিত দ্রব কণাগুলোর ব্যাস 107-10 cm হয়। এ কারণে দ্রবণে দ্রবীভূত দ্রবের অণু বা আয়নগুলোকে উচ্চ ক্ষমতা সম্পন্ন অণুবীক্ষণ যন্ত্রের সাহায্যেও দেখা যায় না ।
iii. দ্রবণ এক দশাবিশিষ্ট সমসত্ত্ব মিশ্রণ।
iv. দ্রবণের মধ্যে উপাদানগুলোর আপেক্ষিক পরিমাণ একটি নির্দিষ্ট সীমার মধ্যে পরিবর্তন করা যায় ।
v. দ্রবণের যেকোনো অংশের উপাদানগুলোর আপেক্ষিক পরিমাণ একই থাকে। এজন্য দ্রবণের সব অংশের ভৌত ধর্ম ও গঠন অভিন্ন থাকে ।
vi. দ্রবণের মধ্যে দ্রবীভূত দ্রবের কণাগুলোর অণু বা আয়ন হিসেবে থাকায় এদেরকে পরিস্রাবণ প্রক্রিয়ায় পৃথক করা যায় না। তবে বাষ্পীভবন, পাতন, কেলাসন প্রভৃতি সাধারণ পরীক্ষাগার প্রণালীর সাহায্যে দ্রবকে দ্রবণ থেকে পৃথক করা যায় ।
vii. দ্রবণের বর্ণ সব সময় দ্রবীভূত দ্রবের বর্ণের উপর নির্ভর করে। যদি দ্রবটি আয়নিক প্রকৃতির হয়, তবে সেক্ষেত্রে দ্রবণের বর্ণ দ্রবণে উপস্থিত আয়নের উপর নির্ভর করে। যেমন- CuSO4 এর জলীয় দ্রবণ নীল বর্ণ হয় Cu2+ আয়নের জন্য, KMnO4 এর জলীয় দ্রবণ বেগুনি হয় MnO, আয়নের জন্য, FeSO4 এর জলীয় দ্রবণ সবুজ হয় Fe2+ আয়নের জন্য।
viii.দ্রবণ তৈরির সময় তাপের উদ্ভব বা শোষণ হতে পারে। যেমন- CaO কে পানিতে দ্রবীভূত করতে তাপের উদ্ভব হয় কিন্তু KNO3 কে পানিতে দ্রবীভূত করলে তাপের শোষণ ঘটে।
দ্রবণ নিয়ে বিস্তারিত ঃ
