দ্রাব্যতার গুণফল ও অধঃক্ষেপন বিক্রিয়া আমাদের আজকের আলোচনার বিষয়। এই পাঠটি “এইচএসসি রসায়ন ১ম পত্র” এর “দ্রবণ ও দ্রাব্যতা” ইউনিট ৬ এর অন্তর্ভুক্ত।
Table of Contents
দ্রাব্যতার গুণফল ও অধঃক্ষেপন বিক্রিয়া
দ্রাব্যতা গুণফল (Solubility Product )
নির্দিষ্ট তাপমাত্রায় স্বল্প দ্রবণীয় লবণের সম্পৃক্ত দ্রবণে লবণটির আয়নগুলোর যে ঘনমাত্রায় থাকে (গ্রাম-আয়ন/লিটার এককে), তার যথাযথ ঘাতে উন্নীত সেই ঘনমাত্রাগুলোর গুণফলকে ঐ তাপমাত্রায় ঐ স্বল্প দ্রবণীয় লবণের দ্রাব্যতা গুণফল বলা হয়। মনে করি, A,B, একটি স্বল্প দ্রবণীয় লবণ যার সম্পৃক্ত দ্রবণে বিয়োজনের সাম্যাবস্থা নিম্নরূপ :
A,B, (অদ্রবণীয়) == xA (aq) + yBT (aq)
এখানে, y* ও x যথাক্রমে ক্যাটায়ন ও অ্যানায়নের আধান।
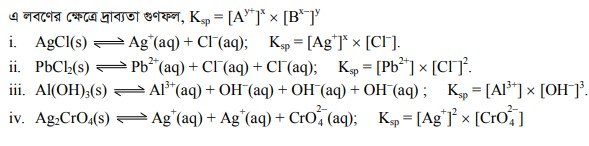
দ্রাব্যতা গুণফলের নীতি :
দ্রাব্যতা গুণফলের নীতি হলো- নির্দিষ্ট তাপমাত্রায় কোনো স্বল্প দ্রবণীয় লবণের দ্রবণে লবণটি দ্রবীভূত বা অধঃক্ষিপ্ত হবে কিনা, তা নির্ভর করে ঐ তাপমাত্রায় লবণটির দ্রাব্যতা গুণফলের মানের উপর। যদি দ্রবণে উপস্থিত কোনো লবণের মধ্যস্থিত আয়নগুলোর যথোপযুক্ত ঘাতসহ মোলার ঘনমাত্রার গুণফল ঐ তাপমাত্রায় লবণটির দ্রাব্যতা গুণফলকে অতিক্রম করে যায়, তবে লবণটি দ্রবণ থেকে অধঃক্ষিপ্ত হয়। যদি ঐ গুণফলের মান লবণটির দ্রাব্যতা গুণফলের মানকে অতিক্রম করতে না পারে, তবে লবণটি দ্রবণে দ্রবীভূত থাকে ।
ঘাতসহ আয়নিক ঘনমাত্রায় গুণফল > Ksp ; অধঃক্ষেপ পড়বে।
ঘাতসহ আয়নিক ঘনমাত্রার গুণফল < Ksp ; অধঃক্ষেপ পড়বে না।
ঘাতসহ আয়নিক ঘনমাত্রার গুণফল = Ksp ; দ্রবণটি সম্পৃক্ত হবে।
দ্রাব্যতার উপর সম-আয়ন প্রভাব :
কোনো স্বল্প দ্রবণীয় লবণের সম্পৃক্ত দ্রবণে সম আয়নবিশিষ্ট কোনো তীব্র তড়িৎ বিশ্লেষ্য পদার্থ যোগ করলে স্বল্প দ্রাব্যতা বিশিষ্ট লবণটির দ্রাব্যতার হ্রাস ঘটে। অর্থাৎ স্বল্প তড়িৎ বিশ্লেষ্যের বিয়োজনের হ্রাস ঘটে। উদাহরণস্বরূপ MA একটি স্বল্প দ্রবনীয় লবণ। এ লবণের সম্পৃক্ত জলীয় দ্রবণে সাম্যাবস্থা MA (অদ্রবীভূত) = M (aq) + A (aq)
এ দ্রবটির দ্রাব্যতার গুণফল, Ksp = [M]. [A]
কোনো নির্দিষ্ট তাপমাত্রায় MA লবণের সম্পৃক্ত দ্রবণে [M ] ও [A] আয়নের মোলার ঘনমাত্রার গুণফল সর্বদা ধ্রুবক এবং এ গুণফলের মান ঐ তাপমাত্রায় লবণটির দ্রাব্যতার গুণফলের সমান। এখন MA লবণের সম্পৃক্ত দ্রবণে যদি সমআয়ন বিশিষ্ট একটি তীব্র তড়িৎ বিশ্লেষ্য পদার্থ MX অথবা YA যোগ করা হয় তাহলে সেক্ষেত্রে দ্রবণে সম আয়ন M’ অথবা A- এর ঘনত্বের বৃদ্ধি ঘটবে। কিছু নির্দিষ্ট তাপমাত্রায় Ksp এর মান নির্দিষ্ট। কাজেই Ksp এর মান স্থির রাখার জন্য কিছু সংখ্যক সম আয়ন M’ অথবা A অপর আয়নের সাথে যুক্ত হয়ে অদ্রবণীয় MA উৎপন্ন করবে।
এর ফলে MA এর দ্রাব্যতার হ্রাস ঘটবে। যেমন : AgCl এর সম্পৃক্ত দ্রবণে তীব্র তড়িৎ বিশ্লেষ্য NaCl এর দ্রবণ যোগ করা হয়। তবে AgCl এর দ্রাব্যতা হ্রাস পায়। অর্থাৎ বিশুদ্ধ পানিতে AgCl এর দ্রাব্যতা, NaCl এর জলীয় দ্রবণে AgCl এর দ্রাব্যতা অপেক্ষা বেশি। আবার বিশুদ্ধ পানিতে NHOH এর দ্রাব্যতা, NH,Cl এর জলীয় দ্রবণে NH,OH এর দ্রাব্যতা অপেক্ষা বেশি।
দ্রাব্যতা গুণফল নীতির প্রয়োগ
কোনো সম্পৃক্ত দ্রবণে লবণের আয়নিক গুণফল এবং দ্রাব্যতা গুণফল বস্তুত একই। সুতরাং যখন কোনো লবণের আয়নিক গুণফল তার দ্রাব্যতা গুণফলকে অতিক্রম করে তখন তা অধঃক্ষিপ্ত হয়। এ কারণে দ্রাব্যতা গুণফল নীতি বিশ্লেষণী রসায়নে এক গুরুত্বপূর্ণ ভূমিকা পালন করে । নিচে দ্রাব্যতা গুণফল নীতির কতকগুলো প্রয়োগ আলোচনা করা হলো ।
(ক) লবণ বিশুদ্ধকরণ : সাধারণ লবণ বিশুদ্ধ করার সময় লবণের সম্পৃক্ত দ্রবণের ভাসমান পদার্থ দূর করে এর মধ্যে HCl গ্যাস চালনা করা হয় । সম্পৃক্ত দ্রবণে লবণ নিম্নরূপে বিয়োজিত থাকে
— NaCl → Na+ + CI
HCl গ্যাস চালনা করার ফলে দ্রবণে CI আয়নের ঘনমাত্রা বৃদ্ধি পায়। ফলে NaCl এর আয়নিক গুণফল [Na’] × [CI] এত বৃদ্ধি পায় যে তা লবণের দ্রাব্যতা গুণফলকে অতিক্রম করে । ফলে NaCl এর অতি সম্পৃক্ত দ্রবণ তৈরি হয় এবং বিশুদ্ধ NaCl লবণ অধঃক্ষিপ্ত হয় ।
(খ) সাবানের লবণক্ষেপণ : তেল বা চর্বির ক্ষারীয় আর্দ্রবিশ্লেষণে সাবান তৈরি হয়। সাবানায়নের এই বিক্রিয়ায় উৎপন্ন সাবান কিছু দ্রবণীয় অবস্থায় থাকে। এখন এই দ্রবণে NaCl যোগ করলে সাবানের দ্রাব্যতা হ্রাস পায়। ফলে সাবান জলীয় দ্রবণ থেকে উপরের দিকে ভেসে ওঠে।
(গ) অজৈব আঙ্গিক বিশ্লেষণ : বিশ্লেষণি গ্রুপ-I এ Ag”, Pb2+ এবং Hg’ প্রভৃতি ক্ষারকীয় মূলক বিদ্যমান। পানিতে এসব ধাতব আয়নের ক্লোরাইড লবণের দ্রাব্যতা অন্যান্য ধাতব ক্লোরাইডের দ্রাব্যতার তুলনায় অনেক কম। তাই সম্পৃক্ত দ্রবণে এসব লবণের দ্রাব্যতা গুণফলও কম। ফলে এসব ধাতব আয়নধারী প্রশমিত দ্রবণে কিছু পরিমাণ HCl যোগ করলে ধাতব আয়ন ক্লোরাইড লবণ হিসেবে অধঃক্ষিপ্ত হয়।
অন্যান্য ধাতব ক্লোরাইডের দ্রাব্যতা গুণফল তুলনামূলকভাবে অনেক বেশি হওয়ায় তারা ক্লোরাইড হিসেবে অধঃক্ষিপ্ত হয় না। তা ছাড়া PbCh এর দ্রাব্যতা গুণফল AgCl বা Hg2C2 এর দ্রাব্যতা গুণফল অপেক্ষা বেশি হওয়ায় PbCl2 এর অধঃক্ষেপণ AgCl বা Hg2Cl2 এর মতো সম্পূর্ণ হয় না ।
বিশ্লেষণি গ্রুপ-II এর ক্ষারকীয় মূলকগুলো হচ্ছে Pb2+, Hg2+, Cdt, Cu2+। এ ধাতব আয়নগুলোকে 0.3M HCl এর উপস্থিতিতে H2S গ্যাস চালনা করে সালফাইড হিসেবে (PbS, HgS, CdS, CuS) অধঃক্ষিপ্ত করা হয় । এক্ষেত্রে H2S পানিতে দ্রবীভূত হয় এবং মৃদু এসিড হিসেবে নিম্নরূপে আয়নিত হয়।
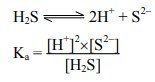
যেহেতু Ka = 1.1×10-2 = ধ্রুবক, কাজেই দ্রবণে H’ আয়নের ঘনমাত্রা যত বৃদ্ধি পাবে S2- আয়নের ঘনমাত্রা তত হ্রাস পাবে। সুতরাং দ্রবণে অম্ল ধর্ম যত তীব্র হবে S2 আয়নের ঘনমাত্রা তত হ্রাস পাবে। ফলে যে ধাতব সালফাইডগুলো অপেক্ষাকৃত কম দ্রবণীয় তারাই এ অবস্থায় সালফাইড হিসেবে অধঃক্ষিপ্ত হবে। Zn, Mn, Ni, Co প্রভৃতি ধাতুর সালফাইডের দ্রাব্যতা গুণফল Cd, Pb, Cu, Hg প্রভৃতির সালফাইডের দ্রাব্যতা গুণফল অপেক্ষা বেশি হওয়ায় Zn, Mn, Ni, Co-এদের সালফাইডের অধঃক্ষেপণ ঘটে না। Cd, Pb, Cu, Hg এদের সালফাইডের দ্রাব্যতা গুণফল অপেক্ষাকৃত অনেক কম হওয়ায় এদের সালফাইডগুলোর আয়নিক গুণফল দ্রাব্যতা গুণফলকে অতিক্রম করে এবং অধঃক্ষিপ্ত হয়।
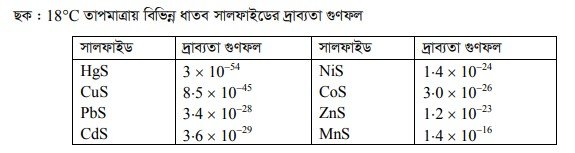
উল্লেখ্য যে, H2S খুব ধীরে ধীরে চালনা করলে প্রথমে Hg, পরে CuS এভাবে অধঃক্ষিপ্ত হবে। অর্থাৎ যে সালফাইডটির দ্রাব্যতা গুণফল সবচেয়ে কম তা সবচেয়ে আগে অধঃক্ষিপ্ত হবে।
বিশ্লেষণি গ্রুপ-III-এ Fet, Alt, Cr+ প্রভৃতি ধাতব আয়ন তাদের হাইড্রোক্সাইড হিসেবে অধঃক্ষিপ্ত হয়। দ্বিতীয় গ্রুপ অতিক্রম করার পর পরিস্রতের মধ্যে 0.1M অ্যামোনিয়াম ক্লোরাইড এবং 3M অ্যামোনিয়াম হাইড্রোক্সাইড মিশিয়ে ক্ষারীয় করা হয়। এ দ্রবণে OH আয়নের ঘনমাত্রা 6 × 107 মোল/লিটার । OH আয়নের এমন কম ঘনমাত্রা কেবল Fe, Al এবং Cr এর হাইড্রোক্সাইডগুলোর যে আয়নিক গুণফল সৃষ্টি করে তা কেবল ঐ হাইড্রোক্সাইডগুলোর দ্রাব্যতা গুণফলকে অতিক্রম করতে পারে। ফলে কেবল এদের হাইড্রোক্সাইড অধঃক্ষিপ্ত হবে।
এই হাইড্রোক্সাইডগুলো পৃথক করার পর অ্যামোনিয়াযুক্ত দ্রবণে H2S চালনা করলে (NH4)2S উৎপন্ন হয়। এটি অতিমাত্রায় আয়নিত হয়ে অধিক ঘনমাত্রায় S2- আয়ন উৎপন্ন করে। S2 আয়নের উচ্চ ঘনমাত্রা Zn, Co, Ni এবং Mn প্রভৃতির সালফাইডের যে আয়নিক গুণফল সৃষ্টি করে, তা উক্ত ধাতব সালফাইডগুলোর তুলনামূলকভাবে উচ্চ দ্রাব্যতা গুণফলকে অতিক্রম করতে পারে । ফলে ঐ সালফাইডগুলো অধঃক্ষিপ্ত হয়।
মনে রাখবেন :
১। এসিড মিশ্রিত Cu2+ আয়ন ও Zn2+ আয়নের দ্রবণে H2S গ্যাস চালনা করলে শুধু CuS অধঃক্ষিপ্ত হয়—
H2S গ্যাস পানিতে স্বল্পমাত্রায় দ্রবণীয়। জলীয় দ্রবণে H2S গ্যাস চালনা করলে এটি বিয়োজিত হয়ে 2H,O’ আয়ন ও S2 আয়ন উৎপন্ন করে ।
এসিডীয় দ্রবণে H2S গ্যাস চালনা করলে এসিডের সমআয়ন H O+ এর উপস্থিতিতে H2S এর বিয়োজনের হ্রাস ঘটে। ফলে দ্রবণে S2- আয়নের ঘনমাত্রা কমে যায়। এখন, এমন একটি দ্রবণ যে দ্রবণে Cu2+ ও Zn2+ উভয় আয়নই উপস্থিত, এ দ্রবণে H2S গ্যাস চালনা করলে দ্রবণে S2- আয়নের ঘনমাত্রা এতই কমে যায় যে কেবল Cu2+ আয়ন ও S2- আয়নের ঘনমাত্রার গুণফল CuS এর দ্রাব্যতা গুণফলের মানকে অতিক্রম করে যায়। ফলে CuS অধঃক্ষিপ্ত হয়। কিন্তু এ অবস্থায় দ্রবণে Zn2+ আয়ন ও S2- আয়নের ঘনমাত্রার গুণফল ZnS এর দ্রাব্যতা গুণফলের মানকে অতিক্রম করতে পারে না বিধায় ZnS এর অধঃক্ষেপ সৃষ্টি হয় না।
২। NaCl দ্রবণ থেকে বিশুদ্ধ NaCl প্রস্তুত করতে HCI এসিড ব্যবহার করা হয়—
অবিশুদ্ধ NaCl কে পানিতে দ্রবীভূত করে দ্রবণ প্রস্তুত করা হয়। দ্রবণকে পরিস্রাবণ করে পরিস্ফুট তরল হিসাবে NaCl এর দ্রবণ পাওয়া যায়। দ্রবণে তাপ প্রয়োগে আরও ঘন দ্রবণে পরিণত করা হয়। NaCl(s) Na (aq) + CI(aq) এ সাম্যাবস্থার সৃষ্টি করে । দ্রবণে 2 4 ফোঁটা গাঢ় HCl যোগ করা হয়। গাঢ় HCl যোগ করার ফলে দ্রবণে CI আয়নের ঘনমাত্রা যথেষ্ট পরিমাণে বেড়ে যায়। ফলে NaCl এর বিয়োজন অস্বাভাবিকভাবে কমে যায়। NaCl এর বিয়োজন এতই কমে যায় যে, এ অবস্থায় NaCl এর আয়নিত গুণফল, [Na’] × [CT] এর দ্রাব্যতা গুণফলকে অতিক্রম করে। ফলে দ্রবণ থেকে বিশুদ্ধ NaCl অধঃক্ষিপ্ত হয় ।
