পর্যায়বৃত্ত ধর্ম: পরমাণুর আকার, যোজ্যতা, ধাতব ধর্ম ও অধাতব ধর্ম আমাদের আজকের আলোচনার বিষয়। এই পাঠটি “এইচএসসি রসায়ন ১ম পত্র” এর “পর্যায় সারণি ও মৌলের পর্যাবৃত্ত ধর্ম” ইউনিট ২ এর অন্তর্ভুক্ত
পর্যায়বৃত্ত ধর্ম: পরমাণুর আকার, যোজ্যতা, ধাতব ধর্ম ও অধাতব ধর্ম
মৌলসমূহের পর্যায়বৃত্ত ধর্ম
পর্যায় সারণির মূল ভিত্তি হলো মৌলের ইলেকট্রন বিন্যাস। মৌলের ইলেকট্রন বিন্যাসে সর্বশেষ ইলেকট্রনটি যে অরবিটালে থাকে মৌলকে পর্যায় সারণির সেই ব্লকে শ্রেণিভুক্ত করা হয়েছে। আবার মৌলের শেষ শক্তি স্তরের যতটি ইলেকট্রন থাকে মৌলকে পর্যায় সারণিতে তত সংখ্যক নম্বরে শ্রেণিভুক্ত করা হয়েছে।
এভাবে মৌলসমূহকে শ্রেণিভুক্ত করার ফলে মৌলসমূহের ভৌত এবং রাসায়নিক ধর্মাবলি নির্দিষ্ট শ্রেণিতে এবং নির্দিষ্ট পর্যায়ে পারমাণবিক সংখ্যার পরিবর্তনে ক্রমান্বয়ে পরিবর্তিত হয় এবং একটি নির্দিষ্ট সংখ্যার পর এসব ভৌত ও রাসায়নিক ধর্মের আবার পুনরাবৃত্তি ঘটে। মৌলের এরূপ ধর্মকে পর্যায়বৃত্তিক ধর্ম বলে। মৌলের পর্যায়বৃত্ত ধর্মগুলো হলো- গলনাঙ্ক ও স্ফুটনাঙ্ক, পরমাণুর আকার, যোজ্যতা, আয়নিকরণ শক্তি, ইলেকট্রন আসক্তি, তড়িৎ ঋণাত্মকতা, ধাতব ধর্ম ইত্যাদি ।
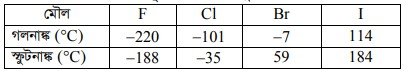
(১) গলনাঙ্ক ও স্ফুটনাঙ্ক : মৌলের গলনাঙ্ক এবং স্ফুটনাঙ্ক একটি পর্যায়বৃত্ত ধর্ম। একটি নির্দিষ্ট শ্রেণিতে উপর থেকে নিচের দিকে যেতে থাকলে দেখা যায় যে, মৌলের পারমাণবিক সংখ্যার ক্রমান্বয়ে বৃদ্ধিতে পরমাণুর আকার বৃদ্ধি পেতে থাকে ফলে পরমাণুর গলনাঙ্ক এবং স্ফুটনাঙ্কও ক্রমান্বয়ে হ্রাস পেতে থাকে। মৌলের পারমাণবিক সংখ্যা বৃদ্ধিতে যোজনী স্তরে ইলেকট্রনের ঘনত্ব কমে যায় ফলে অণুতে পরমাণুসমূহের বন্ধন শক্তির হ্রাস ঘটে। তাই নির্দিষ্ট শ্রেণিতে মৌলসমূহের পারমাণবিক সংখ্যা বৃদ্ধিতে গলনাঙ্ক এবং স্ফুটনাঙ্কের হ্রাস ঘটে। IA শ্রেণির মৌলসমূহের গলনাঙ্ক এবং স্ফুটনাঙ্ক নিম্নে দেখানো হলো :
সারণি-৮ : 1 মৌলসমূহের গলনাঙ্ক ও স্ফুটনাঙ্ক

গ্রুপ 17 হ্যালোজেন মৌলসমূহের ক্ষেত্রে এদের পারমাণবিক সংখ্যা বৃদ্ধির সাথে সাথে গলনাঙ্ক এবং স্ফুটনাঙ্ক বাড়ে। নিম্নের সারণিতে দেখানো হলো :
সারণি-৯ : গ্রুপ-17 মৌলসমূহের গলনাঙ্ক ও স্ফুটনাঙ্ক
(২) পরমাণুর আকার : পরমাণুর আকার এর পারমাণবিক ব্যাসার্ধ দ্বারা প্রকাশ করা হয় । যে পরমাণুর পারমাণবিক ব্যাসার্ধ যত বড় হবে সে পরমাণু আকারে তত বড় হবে। সাধারণত পারমাণবিক ব্যাসার্ধ হলো কোনো পরমাণুর নিউক্লিয়াসের কেন্দ্র হতে এর সর্বশেষ ইলেকট্রন স্তরের দূরত্ব। মৌলসমূহের পরমাণুর আকার সাধারণত (ক) সমযোজী ব্যাসার্ধ (খ) ধাতব ব্যাসার্ধ (গ) ভ্যান্ডার ওয়াল্স ব্যাসার্ধ এবং (ঘ) আয়নিক ব্যাসার্ধ পরিমাপ করে প্রকাশ করা হয়।
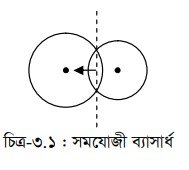
সমযোজী ব্যাসার্ধ হলো সমযোজী বন্ধনে আবদ্ধ দুটি পরমাণুর নিউক্লিয়াসের মধ্যবর্তী দূরত্বের অর্ধেক। মৌলের সমযোজী ব্যাসার্ধকে পারমাণবিক ব্যাসার্ধ বলে। মৌলের পারমাণবিক আকার একটি পর্যায়বৃত্ত ধর্ম। পর্যায় সারণির যেকোনো একটি নির্দিষ্ট শ্রেণিতে উপর থেকে নিচে পারমাণবিক সংখ্যা বৃদ্ধির সাথে সাথে পারমাণবিক ব্যাসার্ধ বৃদ্ধি পায়। কারণ এক্ষেত্রে একটি মৌল হতে নিচের একটি মৌলের পরমাণুতে একটি করে নতুন শক্তিস্তর যোগ হতে থাকে।
আবার, পর্যায় সারণির যেকোনো একটি পর্যায়ে যতই বাম থেকে ডানে যাওয়া যায় ততই পারমাণবিক সংখ্যা বৃদ্ধির সাথে সাথে পরমাণুর আকার তথা পারমাণবিক ব্যাসার্ধ হ্রাস পায়। নির্দিষ্ট পর্যায়ে পারমাণবিক ব্যাসার্ধ হ্রাসের কারণ হলো পারমাণবিক সংখ্যা বৃদ্ধির সাথে সাথে পর্যায়ের কোনো পরমাণুর নতুন শক্তিস্তর যোগ হয় না বরং একই শক্তিস্তরে প্রত্যেকটি পরমাণুর সর্বশেষ শক্তিস্তরে একটি করে ইলেকট্রন এবং নিউক্লিয়াসে একটি করে প্রোটন যুক্ত হয়। ফলে ইলেকট্রনসমূহ নিউক্লিয়াস কর্তৃক আরও জোরে আকৃষ্ট হয় এবং পরমাণুর আকার ক্রমান্বয়ে হ্রাস পায় ।
আয়নিক ব্যাসার্ধ হলো কোন পরমাণুর ধনাত্মক বা ঋণাত্মক আয়ন সৃষ্টির পর ঐ আয়নের নিউক্লিয়াস হতে সর্বশেষ শক্তিস্তরের দূরত্ব। ক্যাটায়ন বা ধনাত্মক আয়নের ব্যাসার্ধ তার পরমাণুর ব্যাসার্ধ অপেক্ষা কম হয়। পরমাণুর শেষ শক্তিস্তর হতে ইলেকট্রন অপসারণের ফলে সর্বশেষ শক্তিস্তরে ইলেকট্রন সংখ্যা হ্রাসের ফলে ইলেকট্রনের মধ্যে বিকর্ষণ বল হ্রাস পায়। আবার নিউক্লিয়াসে প্রোটন সংখ্যা অপরিবর্তিত থাকায় প্রোটন কর্তৃক শেষ শক্তিস্তরের ইলেকট্রনের প্রতি নিউক্লিয়াসের আকর্ষণ পরমাণু অপেক্ষা তার আয়নে অনেক বেশি বৃদ্ধি পায় ফলে আয়নের আয়নিক ব্যাসার্ধ হ্রাস পায়। নিম্নে 1 শ্রেণির মৌলসমূহের আয়নিক এবং সমযোজী ব্যাসার্ধ দেখানো হলো :
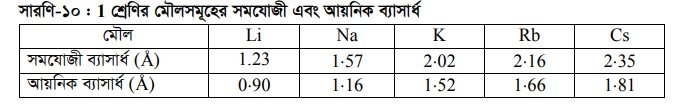
অ্যানায়ন বা ঋণাত্মক আয়নের ব্যাসার্ধ তার পারমাণবিক ব্যাসার্ধ অপেক্ষা বেশি হয়। কারণ পরমাণুতে ইলেকট্রন সংযোজনের ফলে সর্বশেষ শক্তিস্তরে ইলেকট্রন সংখ্যা বেড়ে যায় ফলে একই শক্তিস্তরে ইলেকট্রনসমূহের মধ্যে বিকর্ষণ বল বৃদ্ধি পায় আবার নিউক্লিয়াসে প্রোটন সংখ্যার কোনো পরিবর্তন হয় না। তাই অ্যানায়নের ক্ষেত্রে সর্বশেষ স্তরের ইলেকট্রনের প্রতি নিউক্লিয়াসের আকর্ষণ তার পরমাণু অপেক্ষা হ্রাস পায় ফলে অ্যানায়নের ইলেকট্রন মেঘের আকারের বিস্তৃতি ঘটে অর্থাৎ অ্যানায়নের আকার তার পরমাণুর আকার অপেক্ষা বেশি হয়।
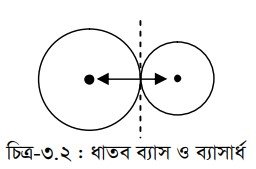
ধাতব ব্যাসার্ধ হলো ধাতুর কেলাসে পরস্পর সংলগ্ন দুটি পরমাণুর একটির নিউক্লিয়াস হতে অপর পরমাণুটির নিউক্লিয়াসের দূরত্বের অর্ধেক। পরমাণুর সমযোজী ব্যাসার্ধ অপেক্ষা ধাতব ব্যাসার্ধ বড় হয়। এতে বোঝা যায়, সমযোজী বন্ধন অপেক্ষা ধাতব বন্ধন দুর্বল প্রকৃতির হয়। Li এর ধাতব ব্যাসার্ধ হলো 152 pm অথচ সমযোজী ব্যাসার্ধ 123 pm ।
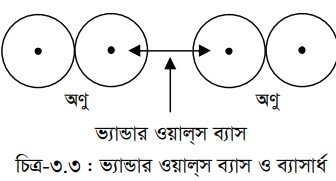
আবার, ভ্যান্ডার ওয়াল্স ব্যাসার্ধ অণুতে ভ্যান্ডার ওয়াল্স বলের কার্যকারিতার উপর নির্ভর করে । যখন দুটি অণুর মধ্যে ভ্যান্ডার ওয়াল্স বল কার্যকরী থাকে, তখন নিকটতম দুটি অণুর পাশাপাশি পরমাণুদ্বয়ের আন্তঃনিউক্লিয়ার দূরত্বের অর্ধেককে ভ্যান্ডার ওয়াল্স ব্যাসার্ধ বলে। পরমাণুর ভ্যান্ডার ওয়াল্স ব্যাসার্ধ তার সমযোজী ব্যাসার্ধ অপেক্ষা বড়। যেমন- আয়োডিনের সমযোজী ব্যাসার্ধ হলো 128 pm অথচ ভ্যান্ডার ওয়াল্স ব্যাসার্ধ হলো 215 pm ।
(৩) মৌলের যোজ্যতা (Valency of Element) : কোনো মৌলের ইলেকট্রন বিন্যাসে সর্বশেষ শক্তিস্তরে যত সংখ্যক ইলেকট্রন থাকে অথবা যত সংখ্যক বিজোড় ইলেকট্রন থাকে তাকে মৌলের যোজনী বা যোজ্যতা বলে। ধাতব মৌলের ক্ষেত্রে সর্বশেষ শক্তিস্তরের ইলেকট্রন সংখ্যা এবং অধাতব মৌলের ক্ষেত্রে সর্বশেষ শক্তিস্তরের বিজোড় ইলেকট্রনের সংখ্যা মৌলের যোজ্যতা নির্দেশ করে। মৌলের যোজ্যতা ইলেকট্রনের সংখ্যা পারমাণবিক সংখ্যা বৃদ্ধির সাথে পর্যায় ক্রমে আবর্তিত হয় বলে মৌলের যোজ্যতাও একটি পর্যায়বৃত্ত ধর্ম।
পর্যায় সারণির যেকোনো একটি নির্দিষ্ট শ্রেণিতে পারমাণবিক সংখ্যার নির্দিষ্ট ক্রম অনুসারে (যেমন— 2, 8, 8, 18……… ইত্যাদি) পরিবর্তনে মৌলসমূহের যোজ্যতা ইলেকট্রন একই থাকে । 1-শ্রেণির মৌলসমূহের ইলেকট্রন বিন্যাস হতে দেখা যাচ্ছে যে, মৌলসমূহের পারমাণবিক সংখ্যা 2, 8, 8, 18, 18 এবং 32 পর পর সর্বশেষ শক্তিস্তরে অর্থাৎ যোজ্যতা ইলেকট্রনের সংখ্যা একই থাকছে। আবার, একটি পর্যায়ে পারমাণবিক সংখ্যা এক একক বৃদ্ধিতে মৌলের যোজ্যতা স্তরে প্রতি ক্ষেত্রে একটি করে ইলেকট্রন বৃদ্ধি পায় ।
পর্যায় সারণির পর্যায়ের বাম থেকে ডানে অর্থাৎ 1 শ্রেণি হতে 17 শ্রেণি পর্যন্ত দেখা যায় যে, 1 শ্রেণির মৌলসমূহের যোজ্যতা স্তরে 1টি ইলেকট্রন, 2 শ্রেণির মৌলসমূহের 2টি ইলেকট্রন, 13 শ্রেণির মৌলসমূহের 3টি ইলেকট্রন এবং এভাবে 17 শ্রেণিতে 7টি ইলেকট্রন রয়েছে। সুতরাং মৌলের যোজনী একটি পর্যায়বৃত্ত ধর্ম । নিষ্ক্রিয় গ্যাসসমূহের যোজনী শূন্য ধরা হয় । কারণ এরা স্বাভাবিক অবস্থায় কোনো যৌগ গঠন করে না ।
(৪) ধাতব ধর্ম (Metalic Properties) : পর্যায় সারণিতে বিভিন্ন সারিতে এবং বিভিন্ন শ্রেণিতে অবস্থিত মৌলসমূহকে ধাতু, অধাতু এবং অপধাতুতে ভাগ করা হয়েছে। মৌলের সুনির্দিষ্ট কিছু বৈশিষ্ট্যের কারণে এদের উল্লিখিত নামে বিভক্ত করা হয়েছে। ধাতুর কিছু বিশেষ বৈশিষ্ট্য রয়েছে যেমন— এরা উচ্চ তাপ ও বিদ্যুৎ পরিবাহী, এদের ধাতব দ্যুতি আছে এবং এরা নমনীয় প্রকৃতির। ধাতুর এসব বৈশিষ্ট্যই হলো ধাতব ধর্ম। সাধারণত যেসব মৌলের তড়িৎ ধনাত্মকতা যত বেশি হয় এবং আয়নিকরণ শক্তি যত কম হয় ঐ সব মৌলের ধাতব ধর্ম তত বেশি হয়।
পর্যায় সারণিতে একটি নির্দিষ্ট পর্যায়ে যেহেতু বাম থেকে যতই ডানে যাওয়া যায় ততই পারমাণবিক সংখ্যা বৃদ্ধির সাথে সাথে মৌলের আয়নিকরণ শক্তি বৃদ্ধি পায় এবং তড়িৎ ধনাত্মকা হ্রাস পায় তাই মৌলের ধাতু ধর্মও হ্রাস পায়। তাই পর্যায় সারণির বামে 1 এবং 2 শ্রেণির মৌলসমূহের ধাতু ধর্ম প্রবল অথচ ডান পার্শ্বের 17 শ্রেণির মৌলের ধাতব ধর্ম নেই বললেই চলে। পর্যায় সারণির মাঝামাঝি পর্যায়ে অবস্থিত জার্মেনিয়াম, আর্সেনিক, টেলুরিয়াম প্রভৃতি উপধাতু ।
