এসিড ক্ষারের সাম্যাবস্থা ও লবণের আর্দ্র বিশ্লেষণ আমাদের আজকের আলোচনার বিষয়। এই পাঠটি “এইচএসসি রসায়ন ১ম পত্র” এর “দ্রবণ ও দ্রাব্যতা” ইউনিট ৬ এর অন্তর্ভুক্ত।
Table of Contents
এসিড ক্ষারের সাম্যাবস্থা ও লবণের আর্দ্র বিশ্লেষণ
অম্ল-ক্ষার সাম্যাবস্থা (Acid-Base Equilibrium)
রাসায়নিক পদার্থসমূহের মধ্যে এসিড ও ক্ষারক একটি বিশেষ স্থান দখল করে আছে। অন্যান্য রাসায়নিক সাম্য বিক্রিয়ার মত এসিড ও ক্ষারকের প্রশমন বিক্রিয়াও একটি নির্দিষ্ট অবস্থায় এসে থেমে যায়। বাস্তবে এ অবস্থায় অন্যান্য সাম্য বিক্রিয়ার মত এসিড-ক্ষারক প্রশমন বিক্রিয়ার সম্মুখমুখী ও পশ্চাৎমুখী বিক্রিয়ার গতি সমান হয়, এর ফলে এ অবস্থায় উৎপাদ আর বেড়ে যায় না ।
যে অবস্থায় এসিড-ক্ষারক প্রশমন বিক্রিয়ার উভয় দিকের গতি সমান হয়ে যায় তাকে এসিড-ক্ষারক সাম্যাবস্থা বলে । তবে রাসায়নিক সাম্যাবস্থা ও এসিড-ক্ষারক সাম্যাবস্থার মূল পার্থক্য হলো রাসায়নিক সাম্যাবস্থায় সংশ্লিষ্ট পদার্থগুলো কঠিন, তরল ও গ্যাস যে কোন অবস্থায় থাকতে পারে এবং প্রত্যেক ক্ষেত্রেই পদার্থ আণবিক অবস্থায় থাকে। কিন্তু এসিড-ক্ষারক সাম্যাবস্থার সাথে সংশ্লিষ্ট বিক্রিয়ক ও উৎপন্ন পদার্থগুলো দ্রবণে আয়নিত অবস্থায় থাকে ।
লবণের আর্দ্র বিশ্লেষণ (Hydrolysis of Salts)
এসিড ও ক্ষারের বিক্রিয়ায় লবণ উৎপন্ন হয়। বেশির ভাগ লবণ পানিতে দ্রবীভূত হয়। আবার কোনো কোনো লবণ পানিতে দ্রবীভূত হয় না। এসব লবণের পানিতে দ্রাব্যতা গুণ নেই। লবণ পানিতে দ্রবীভূত হয়ে যে দ্রবণ উৎপন্ন করে তা নিরপেক্ষ, অম্লীয় বা ক্ষারীয় প্রকৃতির হয়। কোনো লবণকে পানিতে দ্রবীভূত করে যে বিক্রিয়ার মাধ্যমে লবণটি জলীয় দ্রবণে H,O’ বা OH আয়নের পরিমাণে বৃদ্ধি ঘটিয়ে দ্রবণটির প্রকৃতি অম্লীয় বা ক্ষারীয় করে, সে বিক্রিয়াকে লবণের আর্দ্র বিশ্লেষণ বলে। লবণের আর্দ্র বিশ্লেষণে লবণটি পানির সাথে বিক্রিয়া করে ওই লবণের উৎপাদন এসিড ও ক্ষার উৎপন্ন করে। যে লবণ পানিতে দ্রবীভূত হয় না সে লবণের আর্দ্র বিশ্লেষণ হয় না ।
বিভিন্ন প্রকার এসিড ক্ষারের বিক্রিয়ায় উৎপন্ন লবণ নিম্নরূপ :
i. তীব্র এসিড ও তীব্র ক্ষারের বিক্রিয়ায় উৎপন্ন লবণ : NaCl, KCl, NaNO3, KNO3, Na2SO4, K2SO4 ইত্যাদি ।
ii. তীব্র এসিড ও মৃদু ক্ষারের বিক্রিয়ায় উৎপন্ন লবণ NHCl, NH 4 NO3, (NH4)2SO4, CuSO4, FeSO4, FeCl3, AlCl3 ইত্যাদি ।
iii. মৃদু এসিড ও তীব্র ক্ষারের বিক্রিয়ায় উৎপন্ন লবণ : Na2CO3, CH 3 – COONa, KCN, H– COONa, K2CO3 ইত্যাদি।
iv. মৃদু এসিড ও মৃদু ক্ষারের বিক্রিয়ায় উৎপন্ন লবণ : (NH4)2CO3, H – COONH4, CH 3 – COONH, ইত্যাদি। লবণের আর্দ্র বিশ্লেষণে উৎপন্ন দ্রবণের প্রকৃতি বিভিন্ন রকমের হয়ে থাকে ।
উদাহরণস্বরূপ : i. তীব্র এসিড ও তীব্র ক্ষারের বিক্রিয়ায় উৎপন্ন লবণ এর জলীয় দ্রবণের প্রকৃতি নিরপেক্ষ বা প্রশম প্রকৃতির হয়। এ লবণের জলীয় দ্রবণের pH মান 7 হয়।
যেমন : NaCl, KCl, NaNO3, KNO3, Na2SO4, K2SO4 প্রভৃতি লবণের জলীয় দ্রবণের প্রকৃতি হয় নিরপেক্ষ।
ii. তীব্র এসিড ও মৃদু ক্ষারের বিক্রিয়ায় উৎপন্ন লবণ এর জলীয় দ্রবণের প্রকৃতি অম্লীয় হয়। এ লবণের জলীয় দ্রবণের pH মান 7 অপেক্ষা ছোট হয়। অর্থাৎ pH < 7। যেমন— NH, C1, NH NO3, (NH4)2 SO4, CuSO4, FeSO4, FeCl3, AlCl3 ইত্যাদি লবণের জলীয় দ্রবণের প্রকৃতি অম্লীয় হয়।
iii. মৃদু এসিড ও তীব্র ক্ষারের বিক্রিয়ায় উৎপন্ন লবণের জলীয় দ্রবণের প্রকৃতি হয় ক্ষারীয়। এ দ্রবণের pH মান 7 অপেক্ষা বড় হয়। অর্থাৎ pH > 7। যেমন : Na2CO3, K2CO3, H – COONa, CH 3 – COONa, KCN ইত্যাদি লবণের জলীয় দ্রবণের প্রকৃতি ক্ষারীয় হয় ।
iv. মৃদু এসিড ও মৃদু ক্ষারের বিক্রিয়ায় উৎপন্ন লবণের জলীয় দ্রবণের প্রকৃতি অম্লীয় বা ক্ষারীয় অথবা নিরপেক্ষ যে কোনোই হতে পারে। অর্থাৎ এরূপ লবণের জলীয় দ্রবণের pH মান 7, 7 অপেক্ষা বড় অথবা 7 অপেক্ষা ছোট হতে পারে। যেমন : (NH4)2CO3 এর জলীয় দ্রবণের pH > 7 অর্থাৎ দ্রবণের প্রকৃতি ক্ষারীয়। H – COONH, এর জলীয় দ্রবণের pH < 7 অর্থাৎ দ্রবণের প্রকৃতি অম্লীয় । CH3COONH, এর জলীয় দ্রবণের pH = 7 অর্থাৎ দ্রবণের প্রকৃতি নিরপেক্ষ । এক্ষেত্রে লবণ থেকে উৎপন্ন যৌগের অনুবন্ধী এসিড এ অনুবন্ধী ক্ষারকের তীব্রতার উপর দ্রবণের প্রকৃতি নির্ভর করে ।
লবণের আর্দ্র বিশ্লেষণের কারণ (Causes of Hydrolysis of Salts)
পানিতে লবণের বিয়োজনের ফলে ক্যাটায়ন ও অ্যানায়নের সৃষ্টি হয়। সাধারণত ক্যাটায়ন ধাতব অংশ এবং অ্যানায়ন অধাতব অংশ হয়। ব্যতিক্রম NH’ এর লবণ। সব সময়ই ক্যাটায়ন হলো লবণ উৎপন্নকারী ক্ষারকের অনুবন্ধী এসিড এবং অ্যানায়নটি লবণ উৎপন্নকারী এসিডের অনুবন্ধী ক্ষারক ।
যেমন HA (এসিড) + BOH (ক্ষার) —→ • B A (লবণ) + H2O
এ বিক্রিয়ার ক্ষেত্রে B’ ক্যাটায়নটি BOH ক্ষারের অনুবন্ধী এসিড এবং A- অ্যানায়নটি HA এসিডের অনুবন্ধী ক্ষারক । এক্ষেত্রে লবণের অনুবন্ধী এসিড তীব্র অথবা মৃদু হতে পারে। একইভাবে লবণের অনুবন্ধী ক্ষারকও তীব্র অথবা মৃদু হতে পারে। স্বাভাবিক নিয়মে লবণের অনুবন্ধী এসিড ও অনুবন্ধী ক্ষারক সমান শক্তিসম্পন্ন হলে লবণের জলীয় দ্রবণের প্রকৃতি হয় নিরপেক্ষ বা প্রশম।
পক্ষান্তরে লবণের অনুবন্ধী এসিড তীব্র ও অনুবন্ধী ক্ষারক দুর্বল হলে জলীয় দ্রবণের প্রকৃতি হয় অম্লীয়। বিপরীতভাবে লবণের অনুবন্ধী এসিড দুর্বল এবং অনুবন্ধী ক্ষারক তীব্র সেক্ষেত্রে জলীয় দ্রবণের প্রকৃতি ক্ষারীয় হয়। আর যদি অনুবন্ধী এসিড ও অনুবন্ধী ক্ষারক উভয়েই তীব্র হয়, সেক্ষেত্রে তাদের তীব্রতার মান অনুযায়ী জলীয় দ্রবণের প্রকৃতি নিরপেক্ষ, অম্লীয় অথবা ক্ষারীয় এর যেকোনোটিই হতে পারে ।
উদাহরণস্বরূপ :
(i) তীব্র এসিড ও তীব্র ক্ষারের বিক্রিয়ায় উৎপন্ন লবণের আর্দ্র বিশ্লেষণ একটি সুনির্দিষ্ট উদাহরণের মাধ্যমে বিষয়টি ব্যাখ্যা করা যাক ।
তীব্র এসিড HCl ও তীব্র ক্ষার, NaOH এর বিক্রিয়ায় উৎপন্ন লবণ NaCl HC1 (তীব্র এসিড) + NaOH (তীব্র ক্ষার) NaCl (লবণ) + H2O (I)
উৎপন্ন লবণ, NaCl তীব্র তড়িৎ বিশ্লেষ্য হওয়ায় পানিতে সম্পূর্ণভাবে আয়নিত হয়ে ক্যাটায়ন, Na* ও অ্যানায়ন, CI উৎপন্ন করে। এক্ষেত্রে ক্যাটায়ন Na’ হলো তীব্র ক্ষার NaOH এর দুর্বল অনুবন্ধী এসিড। একইভাবে অ্যানায়ন CI হলো তীব্র এসিড HCl এর অনুবন্ধী ক্ষারক । পানি মৃদু তড়িৎ বিশ্লেষ্য হওয়ায় দ্রবণে সামান্য পরিমাণ আয়নিত হয়ে সমসংখ্যক H’ ও OH আয়ন উৎপন্ন করে ।
H2O(l) ←→ H'(aq) + OH (aq)
কিন্তু পানিতে উপস্থিত Na+ আয়ন দুর্বল অনুবন্ধী এসিড হওয়ায় উহা পানি থেকে উৎপন্ন OH আয়নকে গ্রহণ করে না। অর্থাৎ Nat + H2O(l) ←→ NaOH + H’ এ বিক্রিয়া ঘটে না এবং একইভাবে CI আয়নটি দুর্বল অনুবন্ধী ক্ষারক হওয়ায় উহা পানি থেকে উৎপন্ন H’ আয়নকে গ্রহণ করে না। অর্থাৎ CI + H2O(l) → HCl + OH এ বিক্রিয়াটিও ঘটে না। সুতরাং, NaCl এর পানিতে দ্রবীভূত হওয়ার কারণে কোনো অতিরিক্ত H’ আয়ন বা OH আয়নের সৃষ্টি হয় না। শুধু পানির বিয়োজনের ফলে উৎপন্ন সম সংখ্যক H’ ও OH আয়ন উপস্থিত থাকে। এ কারণে পানিতে NaCl এর জলীয় দ্রবণের প্রকৃতি হয় প্রশম ।
এভাবে তীব্র এসিড এ তীব্র ক্ষারের বিক্রিয়ায় উৎপন্ন লবণের আর্দ্র বিশ্লেষিত দ্রবণের প্রকৃতি প্রশম হয়।
(ii) তীব্র এসিড ও মৃদু ক্ষারের বিক্রিয়ায় উৎপন্ন লবণের আর্দ্র বিশ্লেষণ এটি মূলত ক্যাটায়নিক আর্দ্র বিশ্লেষণ।
একটি সুনির্দিষ্ট উদাহরণের মাধ্যমে বিষয়টি ব্যাখ্যা করা যাক। তীব্র এসিড HCl ও মৃদু ক্ষার NH, OH এর বিক্রিয়ায় উৎপন্ন লবণ NH CI HC1 (তীব্র এসিড) + NH,OH (মৃদু ক্ষার) NH4C1 (লবণ) + H2O
উৎপন্ন লবণ NH,Cl তীব্র তড়িৎ বিশ্লেষ্য হওয়ায় পানিতে সম্পূর্ণভাবে আয়নিত হয়ে ক্যাটায়ন, NH ও অ্যানায়ন CI উৎপন্ন করে । এক্ষেত্রে ক্যাটায়ন NH’ হলো মৃদু ক্ষার NH, OH এর তীব্র অনুবন্ধী এসিড এবং অ্যানায়ন CI হলো তীব্র এসিড HCl এর + দুর্বল অনুবন্ধী ক্ষারক । পানি মৃদু তড়িৎ বিশ্লেষ্য হওয়ায় দ্রবণে সামান্য পরিমাণ আয়নিত হয়ে সম সংখ্যক H’ ও OH আয়ন উৎপন্ন করে।
H2O(l) ←→ H*(aq) + OH (aq)
কিন্তু পানিতে উপস্থিত তীব্র অনুবন্ধী এসিড NH, অতিসহজে পানি থেকে OH আয়নকে গ্রহণ করে এবং H’ আয়ন উৎপন্ন করে । NH4+ + H2O • NH, OH (OH- গ্রহণ) + H+ (H+ উৎপাদন) এদিকে CI দুর্বল অনুবন্ধী ক্ষারক হওয়ায় তা পানি থেকে H → কে গ্রহণ করে নিজে HCl এর পরিণত হতে পারে না এবং OH ও উৎপন্ন করতে পারে না। অর্থাৎ, CT(aq) + H2O(l) HCl + OH বিক্রিয়াটি ঘটে না।
সুতরাং, NHCl এর জলীয় দ্রবণে উৎপন্ন H’ ও OH আয়নগুলো হলো— পানির বিয়োজনের ফলে উৎপন্ন সম সংখ্যক H’ ও OH আয়ন এবং দ্রবণে NHCl এর উপস্থিতিতে উৎপন্ন অতিরিক্ত H’ আয়ন। এ কারণে সামগ্রিকভাবে জলীয় দ্রবণে H’ আয়নের পরিমাণ OH আয়তনের তুলনায় অধিক হয়। অর্থাৎ দ্রবণে [H’] > [OH ]। ফলে জলীয় দ্রবণের প্রকৃতি হয় অম্লীয়। এক্ষেত্রে শুধু ক্যাটায়নটি আর্দ্র বিশ্লেষণে অংশগ্রহণ করেছে। এ কারণে এ আর্দ্র বিশ্লেষণকে ক্যাটায়নিক আর্দ্র-বিশ্লেষণ বলে ।
(iii) মৃদু এসিড ও তীব্র ক্ষারের বিক্রিয়ায় উৎপন্ন লবণের আর্দ্র বিশ্লেষণ এটি মূলত অ্যানায়নিক আর্দ্র বিশ্লেষণ ।
একটি সুনির্দিষ্ট উদাহরণের মাধ্যমে বিষয়টি ব্যাখ্যা করা যাক ।
মৃদু এসিড CH3-COOH ও তীব্র ক্ষার NaOH এর বিক্রিয়ায় উৎপন্ন লবণ
CH3-COONa । CH3-COOH (মৃদু এসিড) + NaOH (তীব্র ক্ষার) – CH3–COONa+HẠO
উৎপন্ন লবণ CH3COONa তীব্র তড়িৎ বিশ্লেষ্য হওয়ার পানিতে সম্পূর্ণভাবে আয়নিত হয়ে ক্যাটায়ন, Na* ও অ্যানায়ন CH3 —COO— উৎপন্ন করে। এক্ষেত্রে ক্যাটায়ন Na+ হলো তীব্র ক্ষার NaOH এর দুর্বল অনুবন্ধী এসিড এবং অ্যানায়ন CH3- COO— হলো মৃদু এসিড CH3-COOH এর তীব্র অনুবন্ধী ক্ষারক। পানি মৃদু তড়িৎ বিশ্লেষ্য হওয়ায় দ্রবণে সামান্য পরিমাণে আয়নিক হয়ে সম সংখ্যক H’ আয়ন ও OH আয়ন উৎপন্ন করে।
H2O(l) ←→ H'(aq) + OH (aq)
কিন্তু পানি উপস্থিত তীব্র অনুবন্ধী ক্ষারক, CH3-COO অতি সহজে পানি থেকে উৎপন্ন H’ আয়নকে গ্রহণ করে এবং OH উৎপন্ন করে ।
CH3COO®(aq) + H2O(l) → CH3COOH + OH (aq)
সুতরাং CH3COONa এর জলীয় দ্রবণে উৎপন্ন H’ ও OH আয়নগুলো হলো পানির বিয়োজনের ফলে উৎপন্ন সমসংখ্যক HT আয়ন ও OH আয়ন এবং দ্রবণের CH3-COONa এর উপস্থিতিতে অতিরিক্ত OH আয়ন। এ কারণে দ্রবণে সামগ্রিকভাবে OH আয়নের পরিমাণ H’ আয়নের তুলনায় অধিক হয় । অর্থাৎ দ্রবণে [OH ] > [H]]। ফলে জলীয় দ্রবণের প্রকৃতি হয় ক্ষারীয়। এক্ষেত্রে শুধু অ্যানায়নটি আর্দ্র বিশ্লেষণে অংশগ্রহণ করেছে। এ কারণে এ জাতীয় আর্দ্র বিশ্লেষণকে অ্যানায়নিক আর্দ্র বিশ্লেষণ বলে ।
(iv) মৃদু এসিড ও মৃদু ক্ষারের বিক্রিয়ায় উৎপন্ন লবণের আর্দ্র বিশ্লেষণ একটি সাধারণ উদাহরণের মাধ্যমে বিষয়টি ব্যাখ্যা করা যাক। মনেকরি, HA একটি মৃদু এসিড ও BOH একটি মৃদু ক্ষার। এ মৃদু এসিড ও মৃদু ক্ষারের বিক্রিয়ায় উৎপন্ন লবণ BA |
HA + BOH – → BA + H2O.
BA লবণটি জলীয় দ্রবণে বিয়োজিত হয়ে B+ ক্যাটায়ন এবং A অ্যানায়ন উৎপন্ন করে। B’ ক্যাটায়ন মৃদু ক্ষার BOH এর তীব্র অনুবন্ধী এসিড এবং অ্যানায়নটি A মৃদু এসিড HA এর তীব্র অনুবন্ধী ক্ষারক । এখন— অনুবন্ধী এসিড B+ ও অনুবন্ধী ক্ষার A-এর তীব্রতার ক্ষেত্রে তিন ধরনের ঘটনা ঘটতে পারে—
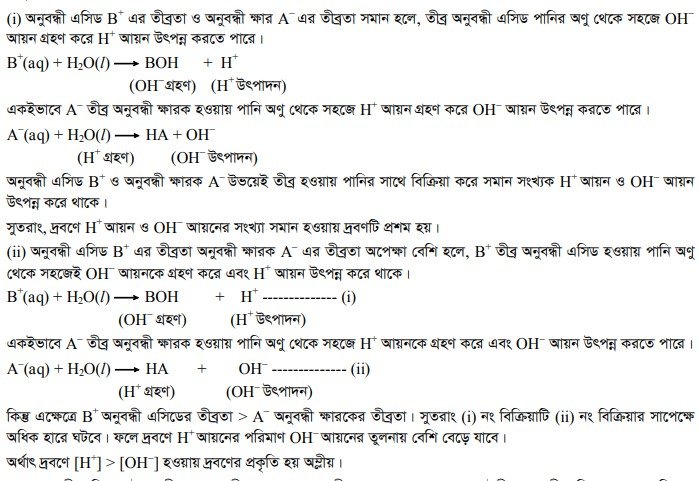


৩. মৃদু তড়িৎ বিশ্লেষ্যের বিয়োজন মাত্রার মান 1 অপেক্ষা ছোট—
মৃদু এসিড বা মৃদু ক্ষার দ্রবণে আংশিকভাবে বিয়োজিত হয়ে আয়ন উৎপন্ন করে থাকে। বিয়োজনে উৎপন্ন আয়নগুলোর সাথে অবিয়োজিত অণুর একটি গতিশীল সাম্যাবস্থা বর্তমান থাকে । তড়িৎ বিশ্লেষ্যের বিয়োজন মাত্রা, a = বিয়োজিত অণুর সংখ্যা/মোট অণুর সংখ্যা
এ আনুপাতিক রাশি হতে দেখা যায় বিয়োজন মাত্রা a. বলতে প্রকৃত অর্থে বোঝায় কোনো তড়িৎ বিশ্লেষ্য উপাদানের 1 mol থেকে mol আয়নিত হয়। এর ( 1 a) mol অ-আয়নিত উপাদান হিসাবে দ্রবণে দ্রবীভূত থাকবে। তীব্র তড়িৎ বিশ্লেষ্য দ্রবণে প্রায় – সম্পূর্ণভাবে আয়নিত অবস্থায় থাকে। ফলে এর বিয়োজন মাত্রা a = 1 হয়; কিছু মৃদু তড়িৎ বিশেষ্যের ক্ষেত্রে এদের আংশিক বিয়োজন ঘটে । সুতরাং মৃদু তড়িৎ বিশ্লেষ্যের বিয়োজন মাত্রা, x এর মান সর্বদা 1 অপেক্ষা ছোট হয় ।
৪. তীব্র তড়িৎ বিশ্লেষ্যের বিয়োজন মাত্রায় মান 1 হয়—
তীব্র এসিড বা তীব্র ক্ষার দ্রবণে প্রায় সম্পূর্ণভাবে বিয়োজিত হয়ে আয়ন উৎপন্ন করে থাকে। তড়িৎ বিশ্লেষ্যের বিয়োজনের ফলে উৎপন্ন আয়নগুলোর সাথে অবিয়োজিত অণুর একটি গতিশীল সাম্যাবস্থা বজায় থাকে । তড়িৎ বিশ্লেষ্যের বিয়োজন মাত্রা, a = বিয়োজিত অণুর সংখ্যা/মোট অণুর সংখ্যা
এ আনুপাতিক রাশি হতে দেখা যায়, বিয়োজন মাত্রা at বলতে প্রকৃত অর্থে বোঝায় কোনো তড়িৎ বিশ্লেষ্য উপাদানের 1 mol থেকে a. mol আয়নিত হয় এবং, (1 – a) mol অ-আয়নিত উপাদান হিসাবে দ্রবণে দ্রবীভূত থাকবে। তীব্র তড়িৎ বিশ্লেষ্যের ক্ষেত্রে দ্রবণে এদের প্রায় সম্পূর্ণ অংশই দ্রবীভূত অবস্থায় থাকে। ফলে এদের বিয়োজন মাত্রা a = 1 হয়। তড়িৎ বিশ্লেষ্য যত তীব্র হয় এ মান তত 1 এর কাছাকাছি এসে পৌঁছায়। খুব বেশি তীব্র তড়িৎ বিশ্লেষ্যের ক্ষেত্রে এ মান 1 হয় ।
