সন্নিবেশ সমযোজী বন্ধন আমাদের আজকের আলোচনার বিষয়। এই পাঠটি “এইচএসসি রসায়ন ১ম পত্র” এর “রাসায়নিক বন্ধন” ইউনিট ৩ এর অন্তর্ভুক্ত।
সন্নিবেশ সমযোজী বন্ধন
সন্নিবেশ বন্ধন (Coordinate bond):
দুটি পরমাণুর বা দুটি যৌগ বা যৌগ ও আয়ন এর মধ্যে রাসায়নিক বন্ধন গঠনের জন্য যে দুটি ইলেকট্রনের প্রয়োজন ওই দুটি ইলেকট্রনই একটি পরমাণু দান করে এবং উভয়েই ওই ইলেকট্রন জোড়টি সমভাবে ব্যবহার করে তাদের সর্ববহিঃস্থ কক্ষে নিষ্ক্রিয় গ্যাসের ইলেকট্রন বিন্যাস লাভ করে। এভাবে ইলেকট্রন জোড় সৃষ্টি করে সমভাবে ব্যবহার করার ফলে যে রাসায়নিক বন্ধনের সৃষ্টি হয় তাকে সন্নিবেশ বন্ধন বলা হয়।
সন্নিবেশ বন্ধন গঠনের সময় যে পরমাণু বা অণু বা আয়ন ইলেকট্রন জোড় দান করে তাকে দাতা বলে। বিপরীতভাবে বন্ধন গঠনের সময় যে পরমাণু বা অণু বা আয়ন ইলেকট্রন জোড় গ্রহণ করে দাতার সাথে ইলেকট্রন জোড়টিকে ব্যবহার করে তাকে গ্রহীতা বলে । এ জাতীয় বন্ধনকে দাতা থেকে গ্রহীতার দিকে তীর চিহ্ন (→) দ্বারা প্রকাশ করা হয়।
সন্নিবেশ বন্ধনের ক্ষেত্রে কতগুলো পূর্বশর্ত মেনে চলার প্রয়োজন হয়। যেমন-
(i) সন্নিবেশ বন্ধনে অংশগ্রহণকারী দুটি পরমাণুর ক্ষেত্রে বন্ধনে অংশগ্রহণকারী দাতা পরমাণুর সর্ববহিঃস্থ শক্তিস্তরের কোনো অরবিটালে কমপক্ষে একটি নিঃসঙ্গ ইলেকট্রন জোড় থাকতে হবে। অর্থাৎ দাতা গ্রুপটি লিগ্যান্ড বলা হয়।
(ii) ইলেকট্রন জোড় গ্রহণ করার জন্য গ্রহীতার সর্ববহিঃস্থ শক্তিস্তরে বা যোজ্যতা স্তরে অন্ত:ত একটি শূন্য অরবিটাল থাকতে হবে।
(iii) দাতা পরমাণু কর্তৃক দানকৃত ইলেকট্রন জোড় দাতা ও গ্রহীতা উভয় পরমাণুর মধ্যে সমানভাবে বিন্যস্ত থেকে দাতা ও গ্রহীতা উভয় পরমাণু সমানভাবে ব্যবহার করবে। দুটি পরমাণুর মধ্যে কোনো ধরনের সম্পূর্ণভাবে ইলেকট্রনের গ্রহণ বা ত্যাগ ঘটবে না ।
উদাহরণস্বরূপ :
(i) অ্যামোনিয়াম আয়ন (NH) গঠন
NH3 অণুতে N-পরমাণুতে একটি নিঃসঙ্গ ইলেকট্রন জোড় বর্তমান থাকে। H-পরমাণু এর Is অরবিটালের একটি মাত্র ইলেকট্রনকে দান করে H’ আয়নে পরিণত হয়। অর্থাৎ H’ আয়নের একমাত্র অরবিটাল 1s অরবিটালে কোনো ইলেকট্রন থাকে না। NH, অণুর অষ্টকপূর্ণ N-পরমাণু এর নিঃসঙ্গ ইলেকট্রন জোড়টি H’ আয়নের সাথে সমভাবে ব্যবহার করে। ফলে H’ আয়ন নিষ্ক্রিয় গ্যাস He এর ইলেকট্রন গঠন কাঠামো লাভ করে। NH3 ও H+ এর মধ্যে সমভাবে ব্যবহৃত ইলেকট্রনটি সন্নিবেশ বন্ধন গঠনের মাধ্যমে NHt আয়নের সৃষ্টি করে ।
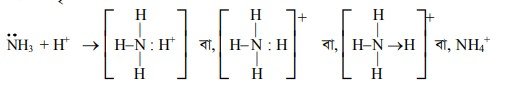
মনে রাখবেন : সন্নিবেশ বন্ধন গঠনের ক্ষেত্রে কোনো আধান নিরপেক্ষ পরমাণু বা অণু বা আয়নের মধ্যস্থিত কোনো পরমাণুর সর্ববহিঃস্থ কক্ষের কোনো অরবিটালে এক জোড়া ইলেকট্রন থাকার প্রয়োজন হয়। পরমাণুর মধ্যে উপস্থিত এ ধরনের ইলেকট্রন জোড়কে নিঃসঙ্গ ইলেকট্রন জোড় ( lone pair of electrons) বলে । নিঃসঙ্গ ইলেকট্রন জোড়কে দুটি ডট চিহ্ন (••) দ্বারা প্রকাশ করা হয়। যেমন- NH, PH, HO, R – NH,, R–OH, SO, ইত্যাদি যৌগের অণুর মধ্যে N, P, O ও S পরমাণুতে নিঃসঙ্গ ইলেকট্রন জোড় বিদ্যমান।
ii) হাইড্রোনিয়াম আয়ন (HÖ) গঠন
পানির (H2O) অণুতে O-পরমাণুতে দুটি নিঃসঙ্গ ইলেকট্রন জোড় বর্তমান থাকে। H-পরমাণু এর Is অরবিটালের একমাত্র ইলেকট্রনটিকে দান করে H’ আয়নে পরিণত হয়। এ কারণে H’ আয়নের একমাত্র অরবিটাল 1s অরবিটালে কোনো ইলেকট্রন থাকে না। পানির অণুতে অষ্টকপূর্ণ O-পরমাণুটির 2টি ইলেকট্রন জোড়ের মধ্যে একটি ইলেকট্রন জোড় H’ আয়ন গ্রহণ করে এবং উভয়ের ইলেকট্রন জোড়টিকে সমভাবে ব্যবহার করে। H’ আয়ন নিষ্ক্রিয় মৌল He এর ইলেকট্রন বিন্যাস লাভ করে HÖ+ আয়ন উৎপন্ন করে।

(iv) অ্যামোনিয়া ও বোরন ট্রাইফ্লোরাইডের সংযোগে গঠিত যৌগ
অ্যামোনিয়া (NH3) যৌগের অণুতে N-পরমাণুতে একটি নিঃসঙ্গ ইলেকট্রন জোড় থাকে। বোরন ট্রাই ক্লোরাইডে (BF3) যৌগের গঠন থেকে দেখা যায় এর কেন্দ্রীয় পরমাণু B-এর সর্ববহিঃস্থ কক্ষে ইলেকট্রন সংখ্যা 6। অর্থাৎ BF3 অণুর কেন্দ্রীয় পরমাণু B-এর অষ্টক অপেক্ষা 2টি ইলেকট্রন কম থাকে। NH3 অণুর অষ্টকপূর্ণ N-পরমাণুর নিঃসঙ্গ ইলেকট্রন জোড়টি বোরন ট্রাই ফ্লোরাইড যৌগের B পরমাণু গ্রহণ করে সুষমভাবে শেয়ার করে। B-পরমাণু অষ্টক পূর্ণ হয় এবং দাতা ও গ্রহীতা উভয় পরমাণু ওই নিঃসঙ্গ ইলেকট্রন


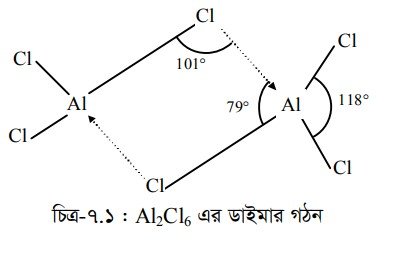
AlCl3 অণুতে A1 পরমাণুর যোজ্যতাস্তরে 6টি ইলেকট্রন বর্তমান অর্থাৎ অষ্টক অপূর্ণ। দুটি AlCl অণুর মধ্যে একটি অণুর একটি Cl পরমাণু এর সর্ববহিঃস্থ কক্ষ থেকে একটি নিঃসঙ্গ ইলেকট্রন জোড় অপর AlCl অণুর Al পরমাণুকে দান করলে ওই Al পরমাণু অষ্টক পূর্ণ হয়। একইভাবে দ্বিতীয় AlCl অণুর একটি Cl-পরমাণু একইভাবে এর একটি নিঃসঙ্গ ইলেকট্রন জোড় প্রথম AlCl3 অণুর Al পরমাণুকে দান করে। প্রথম AlCl এর Al পরমাণুটিও অষ্টক পূর্ণ হয়। এভাবে অ্যালুমিনিয়াম ক্লোরাইড অণুর ডাইমার গঠন AlCl গঠিত হয়।
আরও পড়ুন…

