আদর্শ গ্যাস আমাদের আজকের আলোচনার বিষয়। এই পাঠটি “এইচএসসি রসায়ন ১ম পত্র” এর “পদার্থের অবস্থা” ইউনিট ৪ এর অন্তর্ভুক্ত।
Table of Contents
আদর্শ গ্যাস
আদর্শ গ্যাস (Ideal Gas )
যে গ্যাসসমূহ সকল তাপমাত্রা ও চাপে বয়েলের সূত্র, চার্লসের সূত্র, অ্যাভোগাড্রোর সূত্র তথা আদর্শ গ্যাস সমীকরণ PV = nRT কে মেনে চলে তাদেরকে আদর্শ গ্যাস বলে। প্রকৃতপক্ষে কোনো গ্যাসই সম্পূর্ণরূপে গ্যাস সূত্রসমূহ তথা PV = nRT সমীকরণ মেনে চলে না। আদর্শ গ্যাস হলো একটি কাল্পনিক গ্যাস। স্থির তাপমাত্রায় আদর্শ -গ্যাসের অভ্যন্তরীণ শক্তি আয়তনের উপর নির্ভর করে না ।
আদর্শ গ্যাসের বৈশিষ্ট্য (Characteristics of Ideal Gas)
আদর্শ গ্যাসে নিচের উল্লিখিত বৈশিষ্ট্যসমূহ বর্তমান থাকে ।
১. স্থির তাপমাত্রায় গ্যাসের চাপ ও আয়তনের গুণফল একটি ধ্রুবক। অর্থাৎ PV = K. তাই এক্ষেত্রে যদি স্থির তাপমাত্রায় চাপ বনাম PV এর লেখ অঙ্কন করা যায় তবে তা একটি সরলরেখা হবে।
২. আদর্শ গ্যাস সকল তাপমাত্রা ও চাপে PV = nRT সমীকরণ মেনে চলে ।
৩. স্থির তাপমাত্রায় আদশ গ্যাসের অভ্যন্তরীণ শক্তি এর আয়তনের উপর নির্ভরশীল নয়। অর্থাৎ স্থির তাপমাত্রায় আদর্শ -গ্যাসের আয়তনের পরিবর্তন হলেও এদের অভ্যন্তরীণ শক্তির কোনো পরিবর্তন ঘটে না ।
৪. চাপ অপরিবর্তিত রেখে গ্যাসের তাপমাত্রা 0°C হতে – 273.15°C কমালে গ্যাসের আয়তন শূন্য হয়।
আদর্শ গ্যাস সমীকরণ (Equation of an ideal gas)

প্রকৃত অর্থে এক মোল গ্যাসের ক্ষেত্রে বয়েল ও চার্লসের সূত্রের সমন্বিত রূপটি হলো PV = KT. এ সমীকরণে ধ্রুবক K-এর মান গ্যাসের প্রকৃতি ও ভরের উপর নির্ভরশীল । কেননা, নির্দিষ্ট তাপমাত্রা ও চাপে যেকোনো গ্যাসের আয়তন তার ভরের উপর নির্ভর করেথাকে। কিন্তু 1 মোল বা 1 গ্রাম-অণু গ্যাসের ক্ষেত্রে K-এর মান যে গ্যাসের প্রকৃতির উপর নির্ভর করে না তা অ্যাভোগেড্রো সূত্রের সাহায্যে সহজেই প্রমাণ করা যায়। অ্যাভোগেড্রো সূত্রানুসারে, একই তাপমাত্রা ও চাপে সম-আয়তন সব গ্যাসের মধ্যে সমান সংখ্যক অণু থাকে। আবার, 1 মোল যেকোনো গ্যাসের অণুর সংখ্যা সমান। সুতরাং যেকোনো নির্দিষ্ট তাপমাত্রা ও চাপে 1 মোল যেকোনো গ্যাসের আয়তন একই থাকবে।
তাই 1 মোল যেকোনো গ্যাসের ক্ষেত্রে এর মান বা K এর মান একই হবে। 1 মোল পরিমাণ যেকোনো গ্যাসের জন্য K এর T মানকে R দ্বারা প্রকাশ করা হয়ে থাকে। R-কে বলা হয় মোলার গ্যাস ধ্রুবক। R-এর মান সব গ্যাসের ক্ষেত্রে একই হয় R-এর মান গ্যাসের প্রকৃতির উপর নির্ভরশীল নয়। তাই একে সার্বজনীন গ্যাস ধ্রুবকও বলা হয়। যে কারণে 1 মোল গ্যাসের ক্ষেত্রে PV = KT সমীকরণটিকে PV = RT রূপে প্রকাশ করা হয়ে থাকে। n মোল গ্যাসের ক্ষেত্রে PV = nRT. এ সমীকরণটিকে বলা হয় n মোল আদর্শ -গ্যাসের অবস্থার সমীকরণ। সমীকরণটি আদর্শ গ্যাস সমীকরণ নামেও পরিচিত। সমীকরণটির একটি উল্লেখযোগ্য বৈশিষ্ট্য হলো, সমীকরণটিতে গ্যাসের প্রকৃতির উপর নির্ভরশীল এমন কোনো রাশি নেই। তাই সমীকরণটিকে যেকোনো আদর্শ -গ্যাসের ক্ষেত্রেই প্রয়োগ করা যায় ।
R এর ভৌত তাৎপর্য (Physicl significance of R )

সুতরাং 1 K তাপমাত্রা বৃদ্ধির জন্য প্রতি মোল আদর্শ গ্যাস থেকে যে পরিমাণ কাজ বা শক্তি পাওয়া যায়, তার মান R এর সমান। এটিই R এর ভৌত তাৎপর্য।
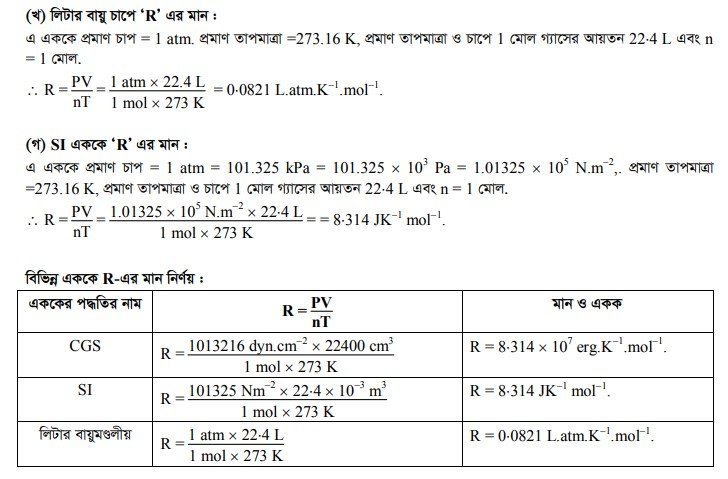
বিভিন্ন এককে মোলার গ্যাস ধ্রুবক R এর মান (Value of molar gas constant in different units)
কাজ বা শক্তিকে বিভিন্ন এককে প্রকাশ করা যায়, তাই বিভিন্ন এককে ‘R’ এর মান বিভিন্ন হয়। অর্থাৎ R ধ্রুবক হলেও এটি শুধু সংখ্যা মাত্র নয়, কাজ বা শক্তির বিভিন্ন এককের উপর R এর মান নির্ভরশীল।