বাস্তব গ্যাস পাঠ আমাদের আজকের আলোচনার বিষয়। এই পাঠটি “এইচএসসি রসায়ন ১ম পত্র” এর “পদার্থের অবস্থা” ইউনিট ৪ এর অন্তর্ভুক্ত।
Table of Contents
বাস্তব গ্যাস পাঠ
বাস্তব গ্যাস (Real Gas )
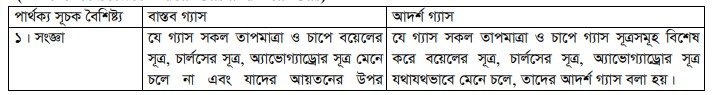
যে গ্যাসসমূহ সকল তাপমাত্রা ও চাপে বয়েলের সূত্র, চার্লসের সূত্র, অ্যাভোগাড্রোর সূত্র তথা আদর্শ গ্যাস সমীকরণ PV = nRT কে মেনে চলে না তাদেরকে বাস্তব গ্যাস বলে। সংক্ষেপে বলা যায়, বাস্তবে যে গ্যাসগুলো পাওয়া যায় তাদেরকে বাস্তব গ্যাস বলে । H2, N2, O2, CO2 প্রভৃতি গ্যাস বাস্তব গ্যাসের উদাহরণ।
উচ্চতাপমাত্রা ও নিম্ন চাপে বাস্তব গ্যাস আদর্শ গ্যাসের ন্যায় আচরণ করে। কিন্তু বিপরীত শর্তে বিচ্যুতি বেশ দেখায় ।
বাস্তব গ্যাসের বৈশিষ্ট্য (Characteristics of Real Gas)
বাস্তব গ্যাসের নিচের উল্লিখিত বৈশিষ্ট্যসমূহ বর্তমান থাকে—
১. বাস্তব গ্যাসসমূহ যথাযথভাবে আদর্শ গ্যাস সমীকরণ PV = nRT মেনে চলে না।
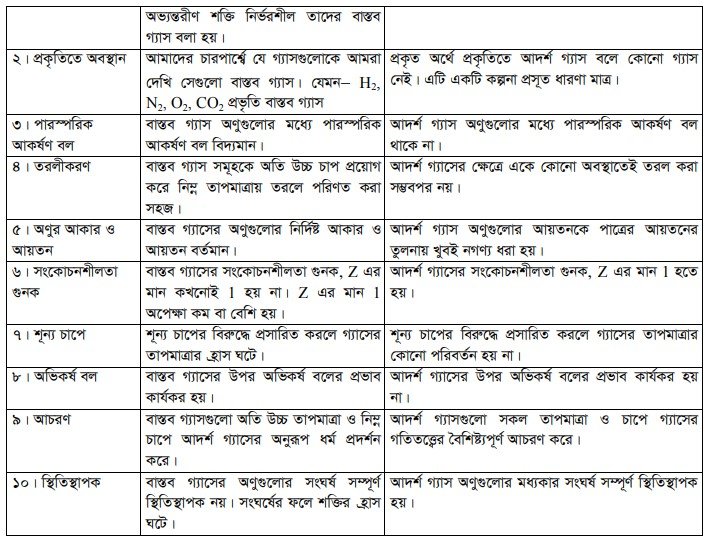
২. বাস্তব গ্যাসের অণুসমূহের মধ্যে আকর্ষণ বল বা বিকর্ষণ বল বিদ্যমান ।
৩. বাস্তব গ্যাসের অভ্যন্তরীণ শক্তি আয়তনের উপর নির্ভরশীল ।
৪. নিম্নচাপ যেমন 1 atm বা তার নিচের চাপ এবং উচ্চ তাপমাত্রায় বাস্তব গ্যাসসমূহ মোটামুটিভাবে প্রায় আদর্শ গ্যাসের ন্যায় আচরণ করে থাকে ।
৫. বাস্তব গ্যাসের ক্ষেত্রে গ্যাস অণুগুলোর মধ্যকার সংঘর্ষ স্থিতিস্থাপক হয় না। এ কারণে আন্ত সংঘর্ষজনিত কারণে তাপের পরিবর্তন ঘটে । PV +1. RT
৬. বাস্তব গ্যাসের ক্ষেত্রে সংকোচনশীল গুনক, Z =
৭. গ্যাস অণুগুলোর মধ্যে পারস্পরিক আকর্ষণ বল কার্যকরী হলেও অতি উচ্চ তাপমাত্রা ও নিম্ন চাপে এরা আদর্শ গ্যাসের মতো আচরণ করে।
আদর্শ গ্যাস ও বাস্তব গ্যাসের মধ্যে পার্থক্য (Difference between Ideal Gas and Real Gas) :
বাস্তব গ্যাসের আদর্শ আচরণ থেকে বিচ্যুতি (Deviation of Real Gases from Ideal behavior’s) :
বাস্তব গ্যাসসমূহ আদর্শ গ্যাসের ন্যায় আচরণ করে না। একমাত্র নিম্ন চাপে এবং উচ্চ তাপমাত্রায় বাস্তব গ্যাসগুলো আদর্শ আচরণ থেকে বিচ্যুতি দেখায় না। বাস্তব গ্যাসের আদর্শ গ্যাসের আচরণ থেকে বিচ্যুতি নিম্নের সমীকরণ দ্বারা ব্যাখ্যা করা যায়।
PV = ZnRT
বা, Z = PV/RT
এখানে Z-কে সংনমন ফ্যাক্টর (Compressibility Factor) বলে । নির্দিষ্ট তাপমাত্রায় Z-এর মান গ্যাসের প্রযুক্ত চাপের উপর নির্ভরশীল। আদর্শ গ্যাসের ক্ষেত্রে Z 1। স্থির তাপমাত্রায় = বিভিন্ন গ্যাসের চাপ (P) এবং আয়তনের (V) গুনফল (PV) বনাম চাপ (P) এর গ্রাফ অঙ্কন করলে দেখা যায় যে, CO2 এবং O2 গ্যাসের PV এর মান প্রথমে হ্রাস পায় এবং পরে বৃদ্ধি পায় কিন্তু H,, He এবং Ne গ্যাসের PV এর মান চাপ (P) বৃদ্ধির সাথে ক্রমান্বয়ে বৃদ্ধি পেতেই থাকে ।
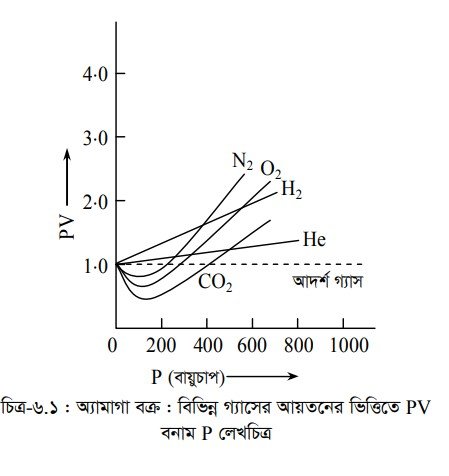
গ্রাফ থেকে দেখা যায় যে,
(i) সকল গ্যাসের কার্ভ চাপ হ্রাসের সাথে সাথে Z-এর আদর্শ মানের কাছাকাছি চলে আসে অর্থাৎ নিম্ন চাপে বাস্তব গ্যাসসমূহ আদর্শ গ্যাসের ন্যায় আচরণ করে ।
(ii) স্বাভাবিক বা মধ্যম চাপে অর্থাৎ যখন PV < RT তখন বাস্তব গ্যাসগুলো আদর্শ গ্যাসের আচরণের গ্রাফ থেকে ঋণাত্মক বিচ্যুতি দেখায়। অর্থাৎ Z < 1 হয়।
(iii) উচ্চ চাপে যখন PV > RT তখন বাস্তব গ্যাসের আদর্শ গ্যাসের কার্ভ থেকে ধনাত্মক বিচ্যুতির কার্ভ পাওয়া যায়। অর্থাৎ Z > 1 হয়।
সন্ধি তাপমাত্রা : প্রতিটি বাস্তব গ্যাসীয় পদার্থের একটি নির্দিষ্ট উষ্ণতা আছে যে উষ্ণতার ওপরে গ্যাসটিকে রেখে যতই চাপ প্রয়োগ করা হোক না কেন সেটিকে আর তরলে পরিণত করা সম্ভব হয় না সেই উষ্ণতাকে উক্ত গ্যাসের সন্ধি তাপমাত্রা বলে। CO2 গ্যাসের ক্ষেত্রে এর মান 31.1°C.
সন্ধি চাপ : কোনো বাস্তব গ্যাসকে সন্ধি তাপমাত্রায় রেখে সেটির উপর ন্যূনতম যে চাপ প্রয়োগ করে সেটিকে তরলে পরিণিত করা যায় সেই চাপকে উক্ত গ্যাসের সন্ধি চাপ বলা হয় ৷
বাস্তব গ্যাসসমূহের আদর্শ আচরণ করার শর্ত (Condition for Ideal behaviour of Real Gases)
গ্যাসের গতিতত্ত্বের সকল স্বীকার্য আদর্শ গ্যাসের জন্য প্রযোজ্য হলেও দুটি স্বীকার্য বাস্তব গ্যাসের জন্য প্রযোজ্য নয়। এ দুটি স্বীকার্য হচ্ছে-
গ্যাসের গতিতত্ত্বের সকল স্বীকার্য আদর্শ গ্যাসের জন্য প্রযোজ্য হলেও দুটি স্বীকার্য বাস্তব গ্যাসের জন্য প্রযোজ্য নয়। এ দুটি স্বীকার্য হচ্ছে-
১। গ্যাসের অণুসমূহের নিজস্ব আয়তন গ্যাস পাত্রের আয়তনের তুলনায় নগণ্য ।
২। গ্যাসাণুসমূহের মধ্যে কোনো আকর্ষণ বা বিকর্ষণ বল নেই ।
গ্যাসের গতিতত্ত্বের যেসব স্বীকার্যের উপর ভিত্তি করে আদর্শ গ্যাস সমীকরণ PV = nRT প্রতিপাদন করা হয়েছে তাতে উপর্যুক্ত দুটি স্বীকার্য সঠিক নয়। তাই বাস্তব গ্যাসসমূহ আদর্শ গ্যাস সমীকরণ মেনে চলে না বা আদর্শ আচরণ করে না। বিজ্ঞানী ভ্যানডার ওয়ালস আদর্শ -গ্যাসের উপর্যুক্ত ত্রুটিপূর্ণ স্বীকার্য দুটি বাস্তব গ্যাসের জন্য সংশোধন করেন।
১ম ত্রুটির সংশোধন : তাঁর মতে, গ্যাসগুলোর নিজস্ব আয়তন পাত্রের আয়তনের তুলনায় একেবারে নগণ্য নয়। তাই আদর্শ -গ্যাস সমীকরণে ব্যবহৃত পাত্রের আয়তন বা পাত্রের গ্যাসগুলোর মুক্ত চলাচলের স্থান V ধরা হয়েছে। কিন্তু প্রকৃতপক্ষে তা সঠিক নয় । এক্ষেত্রে ঐ গ্যাসে যদি n মোল গ্যাস থাকে এবং প্রতি মোল গ্যাস অণুর নিজস্ব আয়তন b হলে গ্যাসাণুসমূহের মুক্ত স্থান (V – nb) হয় ।
এই সমীকরণটি ভ্যানডার ওয়ালস সমীকরণ নামে পরিচিত। যেখানে a ও b হচ্ছে ধ্রুবক। এই সমীকরণ থেকে দেখা যাচ্ছে যে, 2 নিম্নচাপে ও উচ্চ তাপমাত্রায় গ্যাসের আয়তন খুব বেশি হয় এবং na পদটির মান খুবই নগণ্য হয়। তাই গ্যাসের অণুসমূহের v² আণবিক আকর্ষণ বল খুব নগণ্য হয় এবং অতি নিম্নচাপে এবং অতি উচ্চ তাপমাত্রায় গ্যাসাণুগুলোর এই আন্তঃআণবিক আকর্ষণ বল বিলুপ্ত হয় । অর্থাৎ গ্যাসাণুগুলোর মধ্যে আকর্ষণ বা বিকর্ষণ বল থাকে না ।
সুতরাং অতি নিম্নচাপে এবং অতি উচ্চ তাপমাত্রায় বাস্তব গ্যাসাণুগুলো আদর্শ -গ্যাসের ন্যায় আচরণ করে । আবার অতি নিম্নচাপে এবং উচ্চ তাপমাত্রায় গ্যাসের অণুগুলোর দখলকৃত আয়তনের তুলনায় গ্যাসাণুগুলোর নিজস্ব আয়তন খুবই কম হওয়ায় বাস্তব গ্যাস আদর্শ গ্যাসের ন্যায় আচরণ করে। এ কারণে যতই উচ্চ তাপমাত্রা ও নিম্নচাপ ব্যবহৃত হয় বাস্তব গ্যাসগুলো ততই আদর্শ গ্যাসের ন্যায় আচরণ করে। যে উচ্চ তাপমাত্রার ঊর্ধ্বে কোনো বাস্তব গ্যাস আদর্শ -গ্যাসের ন্যায় আচরণ করে তাকে বয়েলের তাপমাত্রা বলে ।
