পানির আয়নিক গুণফল ও এসিড ক্ষারের বিয়োজন ধ্রুবক আমাদের আজকের আলোচনার বিষয়। এই পাঠটি “এইচএসসি রসায়ন ১ম পত্র” এর “দ্রবণ ও দ্রাব্যতা” ইউনিট ৬ এর অন্তর্ভুক্ত।
Table of Contents
পানির আয়নিক গুণফল ও এসিড ক্ষারের বিয়োজন ধ্রুবক
পানির আয়নিক গুণফল (Ionic Product of Water)
1894 সালে বিজ্ঞানী কোলরাস ও হেডউইলার (Kohlrausch and Heydweiller) বিশুদ্ধ পানির পরিবাহিতা মেপে দেখেন যে, বিশুদ্ধ পানিও অতি অল্প পরিমাণে বিদ্যুৎ পরিবহন করে। যেহেতু পানি বিদ্যুৎ পরিবহন করে সেহেতু পানিতে অতি সামান্য পরিমাণে হলেও H’ ও OH আয়ন থাকে। পানির বিয়োজন বিক্রিয়া নিম্নরূপ :

বিশুদ্ধ পানিতে সমান সংখ্যক H’ ও OH আয়ন থাকায় পানি নিরপেক্ষ যৌগ। আবার যদি কোনো দ্রবণে হাইড্রোজেন আয়নের ঘনমাত্রা 107 এর বেশি হয় তবে ঐ যৌগটি অম্লীয় প্রকৃতির এবং 107 এর কম হলে দ্রবণটি ক্ষারীয় প্রকৃতির। তবে দ্রবণ অম্লীয় বা ক্ষারীয় যাই হোক না কেন H’ ও OH আয়নের ঘনমাত্রার গুণফল সর্বদা 10-14 হবে।
এসিড ও ক্ষারের বিয়োজন ধ্রুবক (Dissociation Constant of Acid and Base)
এসিডের বিয়োজন ধ্রুবক : আমরা জানি, এসিড জলীয় দ্রবণে বিয়োজিত হয়ে প্রোটন বা H’ আয়ন উৎপন্ন করে । সাধারণভাবে HB একটি এসিড হলে জলীয় দ্রবণে তা নিম্নরূপে বিয়োজিত হয় :

এক্ষেত্রে Ky কে ক্ষারকের বিয়োজন ধ্রুবক বলা হয়। এর একক mol L’। (ii) নং সমীকরণ হতে দেখা যায় BOH যত বেশি বিয়োজিত হয়ে B’ আয়ন ও OH আয়ন উৎপন্ন করবে ঐ ক্ষারকের Kg এর মান তত বেশি হবে। অর্থাৎ যে ক্ষারক জলীয় দ্রবণে যত বেশি বিয়োজিত হবে ঐ ক্ষারকের Kp এর মান তত বেশি হবে। Ko এর মান দ্বারা ক্ষারকের তীব্রতা প্রকাশ করা হয়। উল্লেখ্য, তীব্র ক্ষার জলীয় দ্রবণে 100% বিয়োজিত হয়।
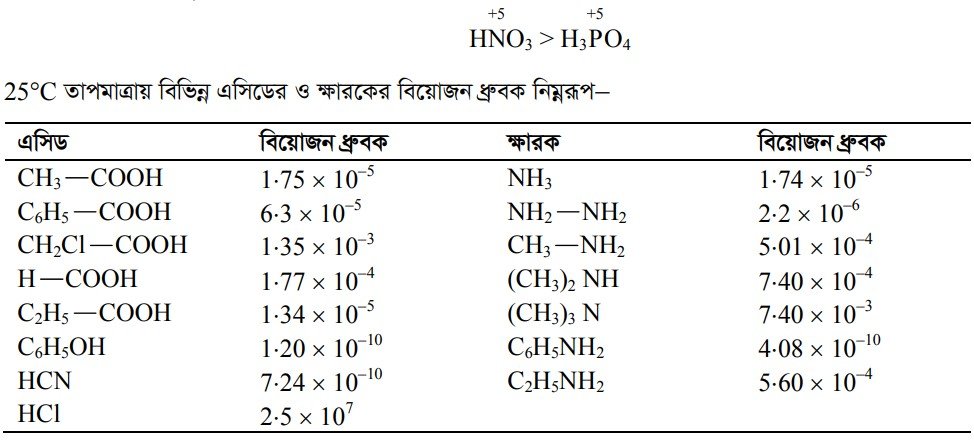
বিয়োজন ধ্রুবক ও এসিড-ক্ষারের তীব্রতা (Dissociation Constant and Strenth of Acids and Bases)
এসিড ও ক্ষার এর আরহেনিয়াস মতবাদ অনুযায়ী জলীয় দ্রবণে যেসব যৌগ হাইড্রোজেন আয়ন দান করে তাদের এসিড বলে এবং যেসব যৌগ হাইড্রোক্সিল আয়ন দান করে তাদেরকে ক্ষারক বলে। আবার ব্রনস্টেড লাউরি বা প্রোটনীয় মতবাদ অনুসারে, যেসব যৌগ প্রোটন দান করে তারা এসিড এবং যেসব যৌগ প্রোটন গ্রহণ করে তারা ক্ষারক । অপরদিকে লুইসের মতবাদ অনুসারে যেসব যৌগ নিঃসঙ্গ ইলেকট্রন জোড় গ্রহণ করতে পারে তারা এসিড এবং যারা এক জোড়া ইলেকট্রন দান করে থাকে তারা ক্ষার।
সুতরাং যেসব এসিড জলীয় দ্রবণে যত সহজেই প্রোটন (H’) উৎপন্ন করতে পারে বা যে এসিড যত সহজেই নিঃসঙ্গ ইলেকট্রন জোড় গ্রহণ করতে পারে তার তীব্রতা তত বেশি। একইভাবে যেসব ক্ষারক যত সহজেই প্রোটন গ্রহণ করতে পারে বা এক জোড়া ইলেকট্রন দান করতে পারে তার তীব্রতা তত বেশি।
এসিডের হাইড্রোজেন আয়ন উৎপন্ন হওয়া বা ক্ষারের হাইড্রোক্সিল আয়ন উৎপন্ন হওয়া তাদের বিয়োজন ধ্রুবকের উপর নির্ভর করে । যে এসিডের বিয়োজন ধ্রুবকের মান যত বেশি ঐ এসিডের তীব্রতা তত বেশি এবং ঐ এসিড দ্রবণে তত সহজেই বিয়োজিত হয়ে হাইড্রোজেন আয়ন উৎপন্ন করতে পারে। একইভাবে যে ক্ষারের বিয়োজন ধ্রুবক এর মান যত বেশি ঐ ক্ষার দ্রবণে তত সহজেই হাইড্রোক্সিল আয়ন দান করতে পারে ।
অম্লের শক্তিমাত্রা নিম্নোক্ত নিয়ামকের উপর নির্ভর করে :
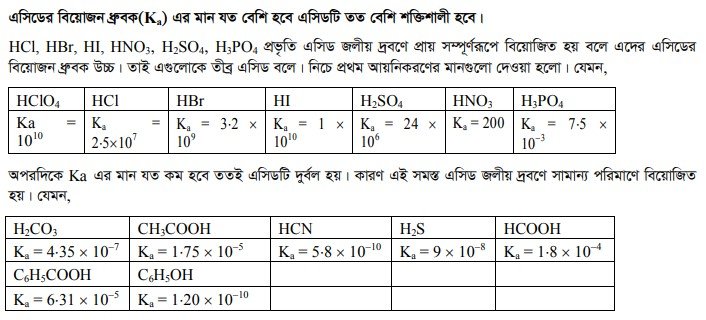
১। এসিডের বিয়োজন ধ্রুবক(Ka) এর মানের উপর ।
২। এসিডের অণুস্থিত ঋণাত্মক আয়নের আকারের উপর।
৩। এসিডের কেন্দ্রীয় পরমাণুর ধনাত্মক জারণ মানের উপর।
৪। এসিডের কেন্দ্রীয় পরমাণুর আকারের উপর ।
এসিডের অণুস্থিত ঋণাত্মক আয়নের আকারের উপর :
হাইড্রাসিডসমূহের তীব্রতা তাদের অণুস্থ ঋণাত্মক আয়নের উপর নির্ভর করে। যে হাইড্রাসিডের ঋণাত্মক আয়ন যত বড় তার অণুর স্থিতিশীলতা তত কম এবং বিয়োজন ঘটে সহজেই। এ জন্য তার তীব্রতা তত অধিক। যেমন, CI আয়নের চেয়ে Br এবং তার চেয়ে I আয়নের আকার বড় বলে HI সহজে বিয়োজিত হয়। তাই এসিডের তীব্রতার ক্রমানুসারে, HI > HBr > HCl > HF
এসিডের কেন্দ্রীয় পরমাণুর ধনাত্মক জারণ মানের উপর :
যে এসিডের অণুতে হাইড্রোজেন ও অক্সিজেনসহ অন্যান্য পরমাণু থাকে তাদেরকে অক্সি-এসিড বলে। যেমন- HNO3, H2SO4, H3PO4, HClO, ইত্যাদি। অক্সি-এসিডের কেন্দ্রীয় পরমাণুর ধনাত্মক জারণ মান যত বেশি ঐ এসিডের তীব্রতা তত বেশি হয়। যেমন,
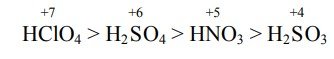
এসিডের কেন্দ্রীয় পরমাণুর আকারের উপর :
যদি কখনো অক্সি-এসিডের কেন্দ্রীয় পরমাণুর জারণ মান সমান হয় তা হলে যে এসিডের পরমাণুর আকার ছোট হবে সে এসিডের তীব্রতা বেশি হবে। কেন্দ্রীয় পরমাণুর আকার ছোট হলে এর চার্জ ঘনত্ব বৃদ্ধি পায়। কেন্দ্রীয় পরমাণুর চার্জ ঘনত্ব বৃদ্ধির সাথে সাথে এসিডের তীব্রতা বৃদ্ধি ঘটে। যেমন, নাইট্রোজেনের আকার ফসফরাস অপেক্ষা কম বলে নাইট্রোজেনের চার্জ ঘনত্ব ফসফরাস অপেক্ষা বেশি হবে । তাই নাইট্রিক এসিড ফসফরিক এসিড অপেক্ষা বেশি শক্তিশালী হবে যদিওবা তাদের জারণ মান সমান ।

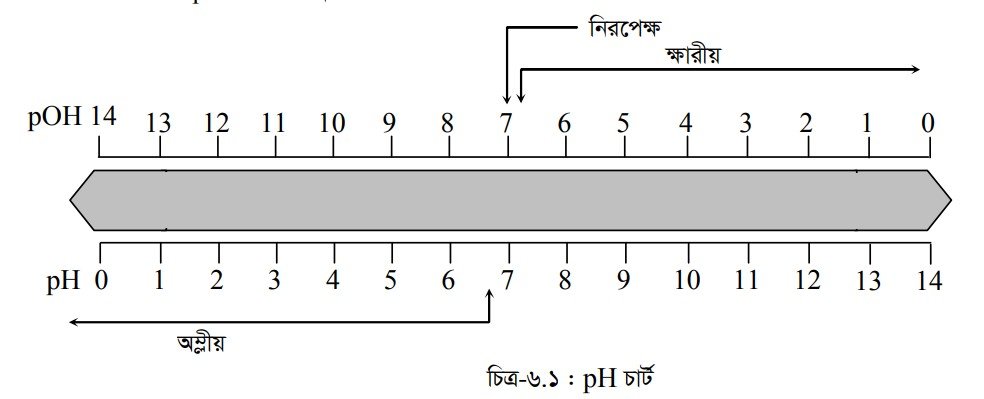
কোনো দ্রবণের H’ আয়নের ঘনমাত্রা বাড়তে থাকলে তার pH কমে এবং ঘনমাত্রা কমলে pH বাড়ে। pH এর মান 7 এর কম হলে দ্রবণ অম্লীয় প্রকৃতির এবং pH এর মান 7 এর বেশি হলে দ্রবণ ক্ষারীয় প্রকৃতির হয়। যে এসিডের pH মান 7 অপেক্ষা যত কম হয় তার তীব্রতা তত বেশি এবং কোনো ক্ষারকের pH মান 7 অপেক্ষা যত বেশি তার তত তীব্রতা বেশি হয় । উল্লেখ্য, এসিডের pH এর মান শূন্য অপেক্ষা কম অর্থাৎ ঋণাত্মক হতে পারে আবার ক্ষারকের pH মান 14 থেকে বেশি হতে পারে ।
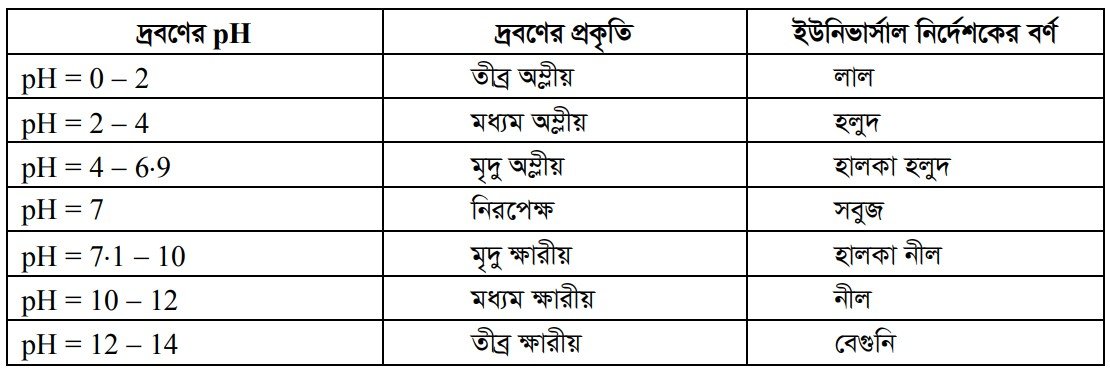
pH-এর মান 0-এর থেকে কম বা 14-এর চেয়ে বেশি হতে পারে কি না । যদিও pH দ্বারা কোনো দ্রবণে হাইড্রোজেন আয়নের মোলার গাঢ়ত্ব প্রকাশ করা হয়, তবুও এটি কেবল লঘু দ্রবণের ক্ষেত্রে প্রযোজ্য । হাইড্রোজেন আয়নের অধিক গাঢ়ত্বের দ্রবণে pH মান 0 থেকে 14-এর মধ্যে থাকে না। যেমন— কোনো দ্রবণে H’ আয়নের গাঢ়ত্ব 1.0 g আয়ন/লিটারের বেশি হলে pH-এর মান 0-এর কম হয় অর্থাৎ ঋণাত্মক হয়। আবার OH আয়নের গাঢ়ত্ব 1.0 g আয়ন/লিটার অপেক্ষা বেশি হলে উক্ত দ্রবণের pH মান 14 অপেক্ষা বেশি হয়ে থাকে। সুতরাং দেখা যাচ্ছে অধিক গাঢ়ত্বের অম্ল বা ক্ষারের দ্রবণের ক্ষেত্রে pH-এর মান 0-এর থেকে কম বা 14-এর থেকে বেশি হতে পারে।

