পরমাণুর ইলেকট্রন বিন্যাস আমাদের আজকের আলোচনার বিষয়। এই পাঠটি “এইচএসসি রসায়ন ১ম পত্র” এর “পারমাণবিক গঠ” ইউনিট ১ এর অন্তর্ভুক্ত
Table of Contents
পরমাণুর ইলেকট্রন বিন্যাস
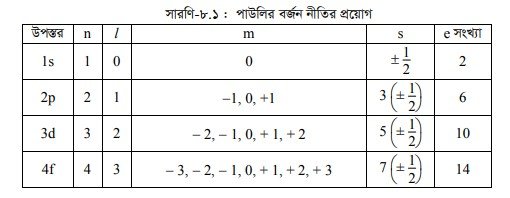
পাউলির বর্জন নীতি (Exclusion Principle of Pauli)
কোয়ান্টাম বলবিদ্যা অনুসারে পরমাণুর বিভিন্ন অরবিটালে ইলেকট্রনসমূহ নির্দিষ্ট নিয়মে সজ্জিত থাকে। পরমাণুর বিভিন্ন অরবিটালে ইলেকট্রনের এরূপ সজ্জাকে পরমাণুর ইলেকট্রন বিন্যাস বলে। যেসব নিয়মে পরমাণুতে ইলেকট্রন সজ্জিত থাকে তা নিম্নরূপ :
১. পাউলির বর্জন নীতি (Pauli Exclusion Principle)
২. আউফবাউ নীতি (Aufbau Principle)
৩. হুন্ডের নিয়ম (Hund’s Rule)
পাউলির বর্জন নীতি (Pauli Exclusion Principle)
পরমাণুর বিভিন্ন অরবিটালে যখন ইলেকট্রন প্রবেশ করে তখন একটি অরবিটালে একই স্পিনবিশিষ্ট দুটি ইলেকট্রন প্রবেশ করতে পারে না। কারণ সমস্পিন বিশিষ্ট ইলেকট্রন পরস্পরকে বিকর্ষণ করে। তবে একই অরবিটালে দুটি ইলেকট্রন প্রবেশ করলে তাদের স্পিন অবশ্যই বিপরীত হবে। এটি পাউলির বর্জন নীতির ফলাফল যা বিজ্ঞানী পাউলি (W.Pauli) 1925 সালে প্রকাশ করেন।
পাউলির বর্জন নীতি নিম্নরূপ :
“একটি পরমাণুতে দুটি ইলেকট্রনের জন্য চারটি কোয়ান্টাম সংখ্যার মান কখনোই একই রূপ হতে পারে না।” (No two electrons can have the same set of four quantum numbers.) দুটি ইলেকট্রনের জন্য n, I, m এর মান একই হলেও স্পিন কোয়ান্টাম সংখ্যার মান ভিন্ন ভিন্ন হবে। যেমন, হিলিয়াম (He) পরমাণুর 2টি ইলেকট্রনের 4টি কোয়ান্টাম সংখ্যার মান নিম্নরূপ :
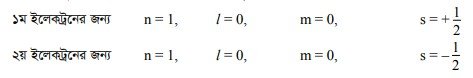
অতএব, হিলিয়াম পরমাণুর ২টি ইলেকট্রন 1 নং কক্ষপথের ‘s’ অরবিটালে অবস্থান করলেও দুটি এর জন্য প্রথম তিনটি কোয়ান্টাম সংখ্যার মান একই হলেও ৪র্থ কোয়ান্টাম সংখ্যার মান ভিন্ন অর্থাৎ ১ম ইলেকট্রনের ঘূর্ণন ঘড়ির কাঁটার দিকে হলে ২য় ইলেকট্রনের ঘূর্ণনের দিক ঘড়ির কাঁটার বিপরীত দিকে হবে।
আউফবাউ নীতি (Aufbau Principle)
‘aufbau’ হলো জার্মান শব্দ। এর অর্থ হলো উপরের দিকে তৈরি করা (building up)। সহজ ভাষায়, একটি ইটের উপর ইট যোগ করে ক্রমান্বয়ে নিচ থেকে উপরের দিকে যেভাবে একটি দেয়াল গঠিত হয় ঠিক একইভাবে পরমাণুতে নিউক্লিয়াসের সবচেয়ে কাছের অরবিটাল প্রথমে ইলেকট্রন দ্বারা পূর্ণ হবে এবং ইলেকট্রনের প্রাপ্যতা সাপেক্ষে পরবর্তীতে ২য় শক্তিস্তর, এরপর তৃতীয় শক্তিস্তর ইত্যাদি ইলেকট্রন দ্বারা পূর্ণ হবে। অর্থাৎ “পরমাণুর নিম্নশক্তিস্তর প্রথমে এবং পর্যায়ক্রমে উচ্চশক্তিস্তর পরে ইলেকট্রন দ্বারা পূর্ণ করার নিয়মকে আউফবাউ নীতি বলে”। এটাকে (n + 1) নীতিও বলা হয়। হুন্ডের নিয়ম আলোচনার পর এটা ব্যাখ্যা করা হয়েছে।
হুন্ডের নিয়ম (Hund’s Rule)
সমশক্তিসম্পন্ন অরবিটালে ইলেকট্রন প্রবেশ করার সময় প্রথমে একটি একটি করে প্রবেশ করবে এবং এদের স্পিন হবে একইমুখী। এভাবে সকল অরবিটালে একটি করে ইলেকট্রন প্রবেশ করার পর ইলেকট্রনের প্রাপ্যতা সাপেক্ষে পুনরায় আরও একটি করে অরবিটালে ইলেকট্রন প্রবেশ করবে। অবশ্য এ ক্ষেত্রে ইলেকট্রনের স্পিন হবে বিপরীতমুখী। সমশক্তিসম্পন্ন অরবিটাল বলতে তিনটি “p” অরবিটাল, পাঁচটি ‘d’ অরবিটাল ও সাতটি ‘f’ অরবিটালকে বোঝানো হয়েছে। s-উপস্তরে একটি মাত্র orbital থাকায় এটি হুন্ডের নিয়মানুযায়ী নাইট্রোজেন এবং অক্সিজেন পরমাণুর ইলেকট্রন বিন্যাস নিম্নে দেখানো হলো :

ইলেকট্রন যদি একমুখী স্পিন করে প্রবেশ করে তা হলে স্পিন যোগফল সর্বাধিক হয় । তখন একে হুন্ডের বহুত্ব বিধি বলে ।
কোয়ান্টাম উপস্তরের শক্তিক্রম
দুটি অরবিটালের মধ্যে কোনোটির শক্তি কম আর কোনোটির শক্তি বেশি তা ( n + 1) এর মান হিসাব করে নির্ণয় করা যায়। দুটি অরবিটালের মধ্যে (n +l) এর মান যে অরবিটালের কম সে অরবিটাল নিম্নশক্তির এবং বেশি স্থিতিশীল। নিম্নশক্তির অরবিটালে প্রথমে ইলেকট্রন প্রবেশ করবে। উদাহরণস্বরূপ, 3d এবং 4s অরবিটালের শক্তি গণনা নিম্নরূপ :
4s অরবিটালের ক্ষেত্রে n = 4; 1 = 0
. ( n + 1) = 4 + 0 = 4
আবার, 3d অরবিটালের ক্ষেত্রে, n = 3, 1 = 2
. ( n + 1) = 3 + 2 = 5
যেহেতু 3d অরবিটালের শক্তি 4s অপেক্ষা বেশি সেহেতু ইলেকট্রন প্রথমে 4s অরবিটালে প্রবেশ করবে এবং 4s অরবিটাল পূর্ণ হলে 3d অরবিটালে প্রবেশ করবে। যেমন, K(19) এবং Ca(20) এর ইলেকট্রন বিন্যাস নিম্নরূপ :
K(19) 1s2 2s2 2p 3s 2 3p 4s’
Ca(20) – 1s 2s 2p 3s23p 4s2
আবার 2টি অরবিটালের (n+l) এর মান সমান হলে, যে অরবিটালে ‘n’ এর মান কম সে অরবিটাল বেশি স্থিতিশীল এবং ইলেকট্রন সে অরবিটাল আগে পূরণ করবে। যেমন, 3d এবং 4p অরবিটাল। এদের শক্তির হিসাব নিম্নরূপ :
3d এর ক্ষেত্রে, n = 3; d = 2
. ( n + 1) = 3 + 2 = 5
4p এর ক্ষেত্রে, n = 4; p=1
( n + 1) = 4 + 1 = 5
যেহেতু 3d অরবিটালের n এর মান (n = 3) 4p অরবিটালের n এর মান (n = 4) অপেক্ষা কম সেহেতু প্রথমে ইলেকট্রন কর্তৃক 3d অরবিটাল পূর্ণ হওয়ার পর 4p অরবিটাল পূর্ণ হবে। যেমন, Sc(21) এর 21 তম ইলেকট্রনটি 4p তে না গিয়ে 3d-তে প্রবেশ করে।
Sc(21) 1s 2 2s 2 2p 3s 2 3p 3d 4s 2
বিভিন্ন অরবিটালের আপেক্ষিক শক্তির ক্রম নিম্নে দেখানো হলো :
1s 2s 2p <3s <3p < 4s <3d <4p < 5s < 4d <5p <6s < 4f <5d<6p <7s <5f6d<7p
কোয়ান্টাম বলবিদ্যা এবং পারমাণবিক বর্ণালি বিশ্লেষণ করে গাণিতিকভাবে প্রাপ্ত বিভিন্ন অরবিটালের আপেক্ষিক শক্তির উচ্চ ক্রম চিত্রে প্রদর্শিত হলো :
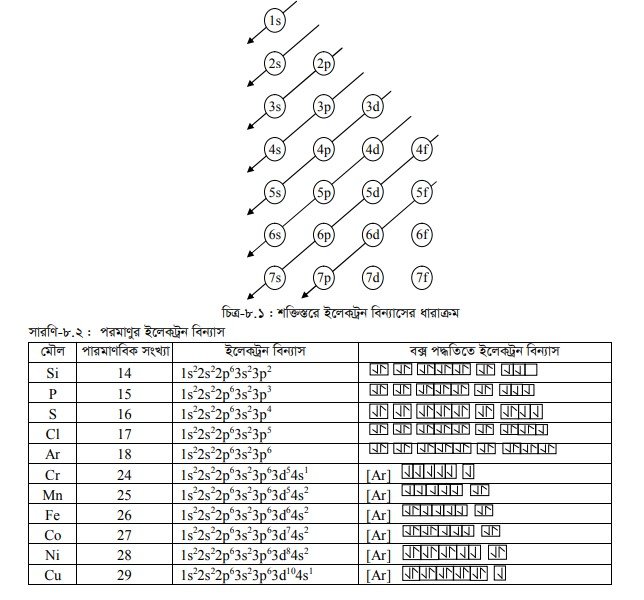

ইলেকট্রন বিন্যাস ব্যাতিক্রম ঃ
