রাসায়নিক বন্ধন আমাদের আজকের আলোচনার বিষয়। এই পাঠটি “এইচএসসি রসায়ন ১ম পত্র” এর “রাসায়নিক বন্ধন” ইউনিট ৩ এর অন্তর্ভুক্ত।
Table of Contents
রাসায়নিক বন্ধন
রাসায়নিক বন্ধনের কারণ (Cause of chemical bond):
রাসায়নিক বন্ধন গঠনের কারণগুলো নিচে আলোচনা করা হলো:
(ক) নিষ্ক্রিয় গ্যাসের গঠন কাঠামো লাভের জন্য (Tendency of acquire electronic configuration of inert gas)
He, Ne, Ar, Kr, Xe, ও Rn এ মৌল কয়টি পর্যায়ে সারণির 18 তম গ্রুপের মৌল। এরা পর্যায় তালিকার নিষ্ক্রিয় মৌল হিসাবে পরিচিত। মৌলগুলোর ইলেকট্রন বিন্যাস—
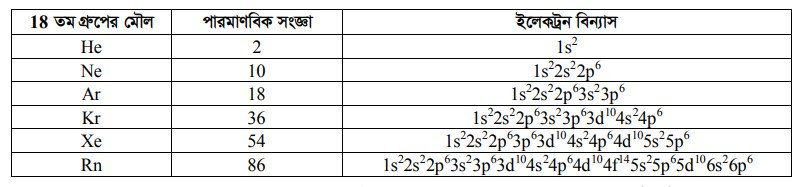
এ ইলেকট্রন বিন্যাস থেকে দেখা যায় He ভিন্ন বাকি সব মৌলগুলোর যোজ্যতাস্তরের ইলেকট্রন বিন্যাস ns np’। এখানে n = 2, 3, 4, 5, 6, অর্থাৎ যোজ্যতাস্তর ইলেকট্রন দ্বারা অষ্টক পূর্ণ। যোজ্যতাস্তর অষ্টক পূর্ণ থাকায় রাসায়নিকভাবে এরা সাধারণত নিষ্ক্রিয় ও অধিক সুস্থিত। এ মৌলগুলো ছাড়া অন্যান্য মৌলের পরমাণুগুলোর যোজ্যতাস্তর ইলেকট্রন দ্বারা অষ্টক পূর্ণ থাকে না। মৌলের পরমাণুগুলো নিজেদের মধ্যে যুক্ত হয় নিষ্ক্রিয় মৌলের পরমাণুর বাইরের কক্ষের ইলেকট্রন বিন্যাস লাভ করার জন্য। মৌলিক অণু ও যৌগিক অণুর গঠনের মাধ্যমে মৌল এ কাজটি সম্পন্ন করে।
(খ) সর্বনিম্ন শক্তি লাভ করার জন্য (Tendency to acquire lowest energy)
বস্তুজগতের সাধারণ নিয়ম অনুযায়ী সব ধরনের সিস্টেম তার নিজস্ব স্থিতিশক্তিকে কমিয়ে স্থায়িত্ব লাভ করার চেষ্টা করে। অণু স্থায়িত্ব লাভ করার জন্য পারস্পরিক আকর্ষণ বল বেড়ে যায়। অণুর মধ্যকার আকর্ষণ বলের বৃদ্ধি এটির মধ্যকার শক্তির মানকে কমিয়ে দেয়। অণুর মধ্যকার এ শক্তির মান যত কমে যায় অণুর স্থায়িত্ব তত বেড়ে যায়। পরীক্ষা করে দেখা গেল যে, হাইড্রোজেন পরমাণুগুলো দ্বারা যখন 1 মোল হাইড্রোজেন উৎপন্ন করা হয় তখন 433 kJ শক্তি বেরিয়ে যায়। হাইড্রোজেন পরমাণু অপেক্ষা এর অণুতে শক্তি অনেক কম থাকে। হাইড্রোজেন পরমাণু অপেক্ষা হাইড্রোজেন অণু অধিক স্থায়ী। নিষ্ক্রিয় মৌল ভিন্ন অন্যান্য মৌলের পরমাণুগুলো স্বাধীনভাবে থাকতে পারে না কিন্তু এদের অণুগুলো স্বাধীনভাবে থাকতে পারে।
যোজ্যতার ইলেকট্রনীয় তত্ত্ব (Electronic theory of valency)
যোজ্যতার ইলেকট্রনীয় মতবাদের উপর সর্বপ্রথম মত প্রকাশ করেন বিজ্ঞানী জি. এন. লুইস (G. N. Lewis) ও ডব্লিউ কোসেল (W. Kossel)। পরবর্তী সময়ে বিজ্ঞানী ল্যাঙ্গমুর (Lengmuir) এই তত্ত্বের সংশোধন করেন।
(i) যোজ্যতা ইলেকট্রন (Valency electron) : যে কোনো মৌলের পরমাণুর সর্ববহিঃস্থ কক্ষের ইলেকট্রনের সংখ্যার উপর যোজ্যতা নির্ভর করে। সর্ববহিঃস্থ কক্ষের এ এক বা একাধিক ইলেকট্রন হলো যোজ্যতা ইলেকট্রন।
(ii) অষ্টক সূত্র (Octet rule) : He ভিন্ন 18 তম গ্রুপের প্রতিটি মৌলের যোজ্যতাস্তরে ইলেকট্রনের সংখ্যা ৪টি। He এর ক্ষেত্রে এ সংখ্যা 2টি। পর্যায় সারণির 1 থেকে 17 তম গ্রুপের প্রতিটি মৌলের যোজ্যতাস্তরে ইলেকট্রনের সংখ্যা 1 থেকে 7 এর মধ্যে থাকে। অর্থাৎ ৪ এর কম। এ মৌলগুলো ওদের সর্ববহিঃস্থ স্তরে ইলেকট্রন সংখ্যা পূর্ণ করে নিষ্ক্রিয় মৌলগুলোর অণুরূপ ইলেকট্রন গঠন কাঠামো লাভ করার প্রবণতা দেখায়।
মৌলের পরমাণুগুলোর সর্ববহিঃস্থ কক্ষে ৪টি ইলেকট্রন পূর্ণ করার প্রক্রিয়া লুইসের অষ্টক সূত্র হিসাবে পরিচিত। তবে H(1), Li(3), Be(4) ও B(5) এ চারটি মৌলের পরমাণুগুলো কিন্তু He এর গঠন কাঠামো প্রাপ্ত হয়। এ মৌলের পরমাণুগুলো এদের সর্ববহিঃস্থ কক্ষে 2টি ইলেকট্রন লাভ করার চেষ্টা করে (B এর ক্ষেত্রে প্রবণতা কম)। এ ইলেকট্রন বিন্যাস লাভ করার পদ্ধতিটি দুই এর নিয়ম বা দ্বৈত সূত্র নামে পরিচিত।
অণুতে যে কোন দুটি পরমাণু যে আকর্ষণ বলের মাধ্যমে পরস্পরের সাথে যুক্ত থাকে তাকে রাসায়নিক বন্ধন বলা হয় । গঠন প্রকৃতির উপর নির্ভর করে রাসায়নিক বন্ধনকে নিম্নোক্তভাবে বিভক্ত করা যায়ঃ
(১) তড়িৎযোজী বা আয়নিক বন্ধন (Ionic bond)
(২) সমযোজী বন্ধন (Covalent bond),
(3) সন্নিবেশ বা সন্নিবেশ সমযোজী বন্ধন (Coordinate bond) এবং
(৪) ধাতব বন্ধন (metallic bond)।
এ বন্ধনগুলি ছাড়াও কোন কোন পদার্থে হাইড্রোজেন বন্ধন (Hydrogen bond) এবং সকল পদার্থে ভ্যানডার ওয়ালস বল (Vander Waal’s force) নামে আরো দুই প্রকার আন্তঃআণবিক আকর্ষণ (Intermolecular attraction) বল সৃষ্টি হয়। আন্তঃআণবিক আকর্ষণ বল সর্বদাই রাসায়নিক বন্ধনের তুলনায় অনেক দুর্বল হয়। এ অধ্যায়ে রাসায়নিক বন্ধন সম্পর্কীত আলোচনাকে সাতটি পাঠে বিভক্ত করা হয়েছে।
তড়িৎযোজী বন্ধন (Ionic bond)
তড়িৎযোজী বন্ধনের প্রবক্তা বিজ্ঞানী কোসেল (Kossel)। তাঁর ধারণা মতে দুই বা ততোধিক পরমাণু রাসায়নিকভাবে যুক্ত হওয়ার ক্ষেত্রে এক বা একাধিক পরমাণু ইলেকট্রন দান করে ধনাত্মক আয়নে পরিণত হয়। উৎপন্ন ধনাত্মক আয়ন নিকটতম নিষ্ক্রিয় মৌলের ইলেকট্রন গঠন কাঠামো প্রাপ্ত হয়। বিপরীতভাবে এক বা একাধিক পরমাণু ইলেকট্রনকে গ্রহণ করে ঋণাত্মক আয়নে পরিণত হয়। উৎপন্ন ঋণাত্মক আয়ন নিকটতম নিষ্ক্রিয় মৌলের ইলেকট্রন গঠন কাঠামো প্রাপ্ত হয়। এভাবে উৎপন্ন দুই বা ততোধিক ধনাত্মক আয়ন ও ঋণাত্মক আয়নের মধ্যে ঘিরে তড়িৎ আকর্ষণ বলের মাধ্যমে যুক্ত হয়ে যৌগ গঠন করে ।
পর্যায় সারণিতে গ্রুপ 1 বা ক্ষার ধাতুগুলোর যোজ্যতাস্তরে 1টি ইলেকট্রন, গ্রুপ 2 বা মৃৎক্ষার ধাতুগুলোর যোজ্যতাস্তরে 2টি এবং 13 তম গ্রুপের মৌলের পরমাণুর যোজ্যতাস্তরে 3টি ইলেকট্রন বর্তমান থাকে। এরা প্রত্যেকেই তড়িৎ ধনাত্মক মৌল এবং প্রয়োজনীয় সংখ্যক ইলেকট্রনকে দান করে ধনাত্মক আয়নে পরিণত হয়। এ ধনাত্মক আয়নগুলোর ক্ষেত্রে মৌলটি যে পর্যায়ে অবস্থান করে ঠিক তার পূর্ববর্তী পর্যায়ের নিষ্ক্রিয় মৌলের গঠন কাঠামো প্রাপ্ত হয়।
পর্যায় তালিকার 15, 16 ও 17 তম গ্রুপের মৌলের যোজ্যতাস্তরে যথাক্রমে 5, 6 3 7 টি করে ইলেকট্রন বর্তমান। এ মৌলগুলো প্রয়োজনীয় সংখ্যক ইলেকট্রনকে গ্রহণ করে ঋণাত্মক আয়নে পরিণত হয়। এভাবে উৎপন্ন ধনাত্মক আয়নকে ক্যাটায়ন ও ঋণাত্মক আয়নকে অ্যানায়ন বলা হয়। উৎপন্ন বিপরীত আধানযুক্ত আয়নগুলো স্থির তড়িৎ আকর্ষণ বলের প্রভাবে পরস্পরের সাথে যুক্ত হয়ে আয়নিক যৌগের কেলাস গঠন করে।
নিকটতম নিষ্ক্রিয় মৌলের ইলেকট্রন গঠন প্রাপ্তির উদ্দেশ্যে রাসায়নিক বিক্রিয়ায় অংশগ্রহণকারী এক বা একাধিক পরমাণুর এক বা একাধিক ইলেকট্রন, অপর এক বা একাধিক পরমাণুর সর্ববহিঃস্থ কক্ষে স্থানান্তরের ফলে দুটি বিপরীত তড়িৎধর্মী আয়নে পরিণত হয়ে স্থির তড়িৎ আকর্ষণ বলের মাধ্যমে পরস্পরের সাথে যুক্ত হয়ে যে বন্ধন গঠন করে তাকে তড়িৎযোজী বা আয়নিক বন্ধন বলে। উৎপন্ন যৌগকে তড়িৎযোজী বা আয়নিক যৌগ বলে। আয়নিক যৌগ গঠনের সময় যৌগের অণুর মধ্যে কোনো মৌলের একটি পরমাণু যত সংখ্যক ইলেকট্রন দান বা গ্রহণ করে সে সংখ্যাই হলো ওই মৌলের যোজ্যতা ।
উদাহরণস্বরূপ : NaCl যৌগের অণুতে Na মৌলের একটি পরমাণু মাত্র 1টি ইলেকট্রনকে দান করে Na+ আয়নে পরিণত হয়। Cl পরমাণু 1 টি ইলেকট্রন গ্রহণ করে CI আয়নে পরিণত হয়। সুতরাং NaCl যৌগে Na এর যোজ্যতা 1 ও Cl এর যোজ্যতাও 1.
MgCl যৌগের অণুতে Mg মৌলের একটি পরমাণু 2টি ইলেকট্রনকে দান করে Mg2+ আয়নে পরিণত হয়। CI মৌলের দুটি পরমাণুর মধ্যে প্রত্যেক CI পরমাণু একটি করে ইলেকট্রন গ্রহণ করে CI আয়নে পরিণত হয়। সুতরাং MgCl2 যৌগে Mg এর যোজ্যতা 2 ও Cl এর যোজ্যতা 1.
তড়িৎযোজী যৌগের উদাহরণ :

তড়িৎযোজী যৌগ গঠনের সময় Na পরমাণু এর যোজ্যতাস্তর ৩য় শক্তিস্তরের s-ইলেকট্রনকে দান করে। Na পরমাণুটি Na* আয়ন পরিণত হয় এবং নিষ্ক্রিয় মৌল Ne এর ইলেকট্রন গঠন প্রাপ্ত হয়। Cl পরমাণু, Na এর দান করা ইলেকট্রনকে গ্রহণ করে CI আয়নে পরিণত হয় এবং নিষ্ক্রিয় মৌল Ar এর ইলেকট্রন গঠন প্রাপ্ত হয়। এভাবে উৎপন্ন দুটি বিপরীত আধান যুক্ত আয়ন দুটি স্থির তড়িৎ আকর্ষণ বলের মাধ্যমে যুক্ত হয়ে NaCl তড়িৎযোজী যৌগ গঠন করে ।
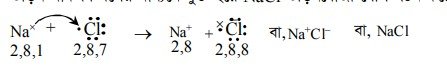

তড়িৎযোজী যৌগ গঠনের সময় Mg পরমাণু এর যোজ্যতাস্তরে ৩য় শক্তিস্তরের দুটি s ইলেকট্রনকে দান করে। Mg পরমাণুটি Mg2+ আয়নে পরিণত হয় এবং নিষ্ক্রিয় মৌল Ne এর গঠন কাঠামো প্রাপ্ত হয়। দুটি CI পরমাণু প্রত্যেকে Mg এর দান করা ইলেকট্রনকে গ্রহণ করে দুটি CI আয়নে পরিণত হয় এবং নিষ্ক্রিয় মৌল Ar এর ইলেকট্রন গঠন প্রাপ্ত হয়। এভাবে উৎপন্ন বিপরীতধর্মী আধান যুক্ত আয়নের মধ্যে স্থির তড়িৎ আকর্ষণ বলের মাধ্যমে যুক্ত হয়ে MgCl2 তড়িৎযোজী যৌগ গঠন করে ।
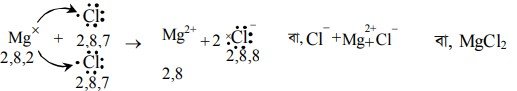
(iii) Na2O এর ক্ষেত্রে
Na মৌলের পারমাণবিক সংখ্যা 11 এবং Na মৌলের পরমাণুর ইলেকট্রন বিন্যাসে, Na = 1s2 2s22p 6 3s
O মৌলের পারমাণবিক সংখ্যা ৪ এবং O মৌলের পরমাণুর ইলেকট্রন বিন্যাস, O = 1s2 2s22p
তড়িৎযোজী যৌগ গঠনের সময় দুটি Na পরমাণুর প্রত্যেকে এর যোজ্যতাস্তর ৩য় শক্তিস্তরের s-ইলেকট্রনকে দান করে দুটি Nat আয়নে পরিণত হয়। Na+ আয়ন নিষ্ক্রিয় মৌল Ne এর গঠন প্রাপ্ত হয়। একটি O পরমাণু, দুটি Na পরমাণুর দান করা দুটি ইলেকট্রন গ্রহণ করে O- আয়নে পরিণত হয় এবং এক্ষেত্রেও নিষ্ক্রিয় মৌল Ne এর গঠন প্রাপ্ত হয়। উৎপন্ন দুটি Na# আয়ন ও একটি O2-আয়ন দিয়ে তড়িৎ আকর্ষণ বলের মাধ্যমে যুক্ত হয়ে Na2O তড়িৎযোজী যৌগ গঠন করে।
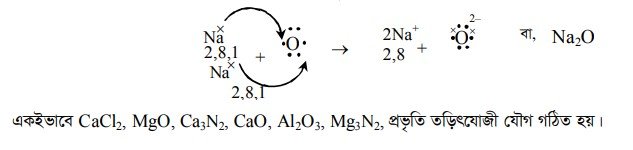
তড়িৎযোজী বন্ধন গঠনের শর্ত
i. যোজ্যতাস্তরে ইলেকট্রন সংখ্যা : যে পরমাণুটি ইলেকট্রন দান করে ধনাত্মক আয়ন তথা ক্যাটায়নে পরিণত হয় এর যোজ্যতাস্তরে ইলেকট্রন সংখ্যা 1, 2 বা 3 হওয়া চাই। বিপরীতভাবে যে পরমাণুটি ইলেকট্রন গ্রহণ করে ঋণাত্মক আয়ন তথা অ্যানায়নে পরিণত হয় এর যোজ্যতাস্তরে ইলেকট্রন সংখ্যা 5, 6 বা 7 হওয়া চাই।
ii. আয়নিকরণ বিভব : যে পরমাণুটি ইলেকট্রন দান করে ধনাত্মক আয়নে পরিণত হয় এর আয়নিকরণ বিভবের মান খুবই কম হওয়া প্রয়োজন। বিপরীতভাবে যে পরমাণুটি ইলেকট্রন গ্রহণ করে ঋণাত্মক আয়নে পরিণত হয় এর আয়নিকরণ বিভবের মান খুব বেশি হওয়া প্রয়োজন ।
iii. তড়িৎ ঋণাত্মকতা : ধনাত্মক আয়নে পরিণত হওয়া পরমাণুর তড়িৎ ঋণাত্মকতার মান খুব কম এবং ঋণাত্মক আয়নে পরিণত হওয়া পরমাণুর তড়িৎ ঋণাত্মকতার মান খুব বেশি হওয়া প্রয়োজন।
iv. পরমাণুর আকার : যে পরমাণুটি ইলেকট্রন দান করে ধনাত্মক আয়নে পরিণত হবে তার আকার বড় হওয়া প্রয়োজন। পরমাণুর আকার বড় হলে যোজ্যতাস্তরের ইলেকট্রনের উপর নিউক্লিয়াসের আকর্ষণ বলের প্রভাব কম হয়। এ কারণে পরমাণুটি খুব সহজেই ইলেকট্রন দান করে ধনাত্মক আয়নে পরিণত হয়।
যে পরমাণুটি ইলেকট্রন গ্রহণ করে ঋণাত্মক আয়নে পরিণত হয় তার আকার ছোট হওয়া প্রয়োজন। আকার ছোট হওয়ার কারণে যোজ্যতাস্তরের ইলেকট্রনের উপর নিউক্লিয়াসের আকর্ষণ বল অধিক মাত্রায় কার্যকর হয়। ফলে পরমাণুটি খুব সহজেই ইলেকট্রন গ্রহণ করে ঋণাত্মক আয়নে পরিণত হয় এবং ঋণাত্মক আয়নটি স্থায়ী হয়।
v. আয়নগুলোর আধানের মান : তড়িৎযোজী যৌগে বর্তমান ধনাত্মক আয়ন কম ধনাত্মক আধানযুক্ত ও ঋণাত্মক আয়ন কম ঋণাত্মক আধানযুক্ত হলে বন্ধন গঠন স্থায়ী হয়। ধনাত্মক আয়নের আধানের মান কম হলে পরমাণু থেকে দান করা ইলেকট্রন ধনাত্মক আয়নের দিকে ফিরে আসার প্রবণতা কম হয়। আবার ঋণাত্মক আয়নের আধান কম হলে পরমাণু দ্বারা গ্রহণ করা ইলেকট্রনের উপর নিউক্লিয়াসের আকর্ষণ বলের প্রভাব বেশি হয়। পরমাণু দ্বারা গ্রহণ করা ইলেকট্রন ঋণাত্মক আয়ন থেকে অপসারিত হতে পারে না। এ কারণে ধনাত্মক ও ঋণাত্মক আয়ন দুটিই বেশি স্থায়ী হয়।
vi. ল্যাটিস শক্তি : তড়িৎযোজী যৌগ গঠনের সময় ল্যাটিস শক্তির মান বেশি হওয়া প্রয়োজন। ল্যাটিস শক্তির মান যত বেশি হয় তড়িৎযোজী বন্ধনটি তত সুদৃঢ় হয়। গ্যাসীয় অবস্থায় ক্যাটায়ন ও অ্যানায়ন থেকে 1 মোল পরিমাণ তড়িৎযোজী কেলাস গঠনের ক্ষেত্রে যে পরিমাণ শক্তি নির্গত হয় তাকে তড়িৎযোজী যৌগের ল্যাটিস শক্তি বলা হয়।
