অরবিটালসমূহের সংকরণ আমাদের আজকের আলোচনার বিষয়। এই পাঠটি “এইচএসসি রসায়ন ১ম পত্র” এর “রাসায়নিক বন্ধন” ইউনিট ৩ এর অন্তর্ভুক্ত।
অরবিটালসমূহের সংকরণ
অরবিটালের সংকরণ (Orbital Hybridization)
সমযোজী বন্ধন গঠনের ক্ষেত্রে পরমাণুর যোজনী স্তরে অযুগ্ম ইলেকট্রন থাকা প্রয়োজন। কোনো পরমাণুর যোজনী স্তরে যে কয়টি অযুগ্ম ইলেকট্রন থাকে সেই সংখ্যাই ঐ মৌলের যোজনী হয়। হাইড্রোজেন, ক্লোরিন এবং অক্সিজেন পরমাণুর অযুগ্ম ইলেকট্রনের সংখ্যা যথাক্রমে H=1টি, Cl=1টি, O=2টি। সুতরাং হাইড্রোজেন এবং ক্লোরিন একযোজী পরমাণু এবং অক্সিজেন দ্বিযোজী পরমাণু। কিন্তু Be, B এবং C ইত্যাদি পরমাণুর ইলেকট্রন বিন্যাসের সাথে তাদের প্রকৃত যোজনীর হিসাব পাওয়া যায় না ।
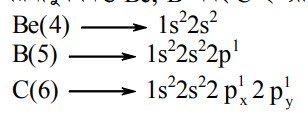
ইলেকট্রন বিন্যাস হতে দেখা যায় Be (4) এর যোজনী স্তরে কোনো অযুগ্ম ইলেকট্রন নেই অর্থাৎ Be(4) এর যোজনী 0 (শূন্য), আবার B(5) এর যোজনী স্তরে একটি ও C(6) এর যোজনী স্তরে ২টি অযুগ্ম ইলেকট্রন রয়েছে। তাই B(s) এর যোজনী 1 (এক) এবং C(6) এর যোজনী 2(দুই) হওয়া উচিত। কিন্তু বাস্তবে Be, B এবং C যথাক্রমে BeCl2, BCl3, CCl4 স্থায়ী যৌগ গঠন করে। এসব যৌগে Be, B এবং C এর যোজনী যথাক্রমে 2, 3 এবং 4। মৌলের পরমাণুর এ ধরনের যোজনী ব্যাখ্যায় বিজ্ঞানীরা বলেন বিক্রিয়াকালে পরমাণুর সমশক্তি বা প্রায় সমশক্তি সম্পন্ন অরবিটালের মধ্যে নিম্নশক্তির অরবিটালের ইলেকট্রন উচ্চস্তরে উন্নীত হয়ে অযুগ্ম ইলেকট্রনের সংখ্যা বৃদ্ধি করে। এ প্রক্রিয়াকে অরবিটালের সংকরীকরণ বলে।
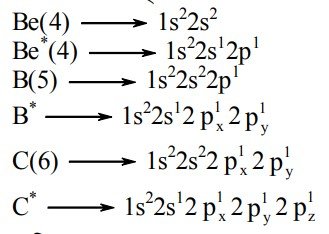
সুতরাং উত্তেজিত (*) অবস্থায় Be, B এবং C এর পরমাণুতে অযুগ্ম ইলেকট্রন সংখ্যা যথাক্রমে 2, 3 এবং 4টি থাকে বলে এদের যোজনী 2, 3 ও 4 হয়।
সংকর অরবিটালের প্রকারভেদ (Classification of Hybrid Orbitals)
অরবিটালের সংকরণ বিভিন্ন প্রকার হতে পারে । যদি একটি s এবং একটি p-অরবিটালের মধ্যে সংকরণ ঘটে তবে 2টি sp সংকর অরবিটালের সৃষ্টি হয়। যদি একটি s এবং তিনটি p-অরবিটালের মধ্যে সংকরণ হয় তবে চারটি sp3 সংকর অরবিটালের সৃষ্টি হয়। এভাবে sp े, dsp3, d’sp3 সংকর অরবিটাল গঠিত হতে পারে ।
(১) sp সংকর অরবিটাল : পরমাণুর একই শক্তিস্তরে অবস্থিত দুটি সমশক্তি সম্পন্ন বা প্রায় সমশক্তি সম্পন্ন অরবিটালের সংকরণে সংকর অরবিটাল গঠিত হয়। যদি একটি s-অরবিটাল এবং একটি p-অরবিটালের মধ্যে সংকরণ ঘটে তবে একই শক্তি সম্পন্ন দুটি sp সংকর অরবিটাল গঠিত হয় ।
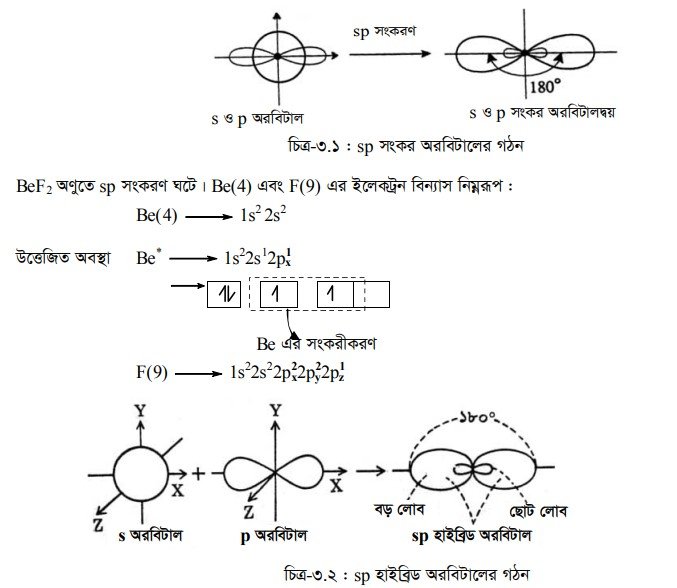
সংকরীকরণের ফলে Be(4) পরমাণুতে ২টি সমশক্তি সম্পন্ন sp অরবিটালের সৃষ্টি হয়। ২টি ফ্লোরিন পরমাণুর ২টি 2p, অরবিটালের সাথে Be এর ২টি sp অরবিটালের অধিক্রমণের ফলে ২টি sppz বন্ধনের সৃষ্টি হয়ে BeF2 অণুর সৃষ্টি হয়।
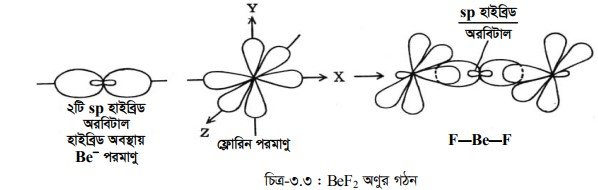
BeF2 অণুটি সরলরৈখিক আকৃতির এবং এর বন্ধন কোণ হবে 180° ।
(২) sp±-সংকর অরবিটাল : একই শক্তিস্তরের একটি s-অরবিটাল এবং ২টি p-অরবিটালের মধ্যে সংকরণ ঘটলে তিনটি sp সমশক্তি সম্পন্ন সংকর বা হাইব্রিড অরবিটাল গঠিত হয়।
পরমাণুর BX3 (এখানে X = F, Cl, Br, I) যৌগের ক্ষেত্রে sp2 সংকরীকরণ ঘটে। BF3 অণু বিবেচনা করে B(5) এবং F(9) ইলেকট্রন বিন্যাস নিম্নরূপ :
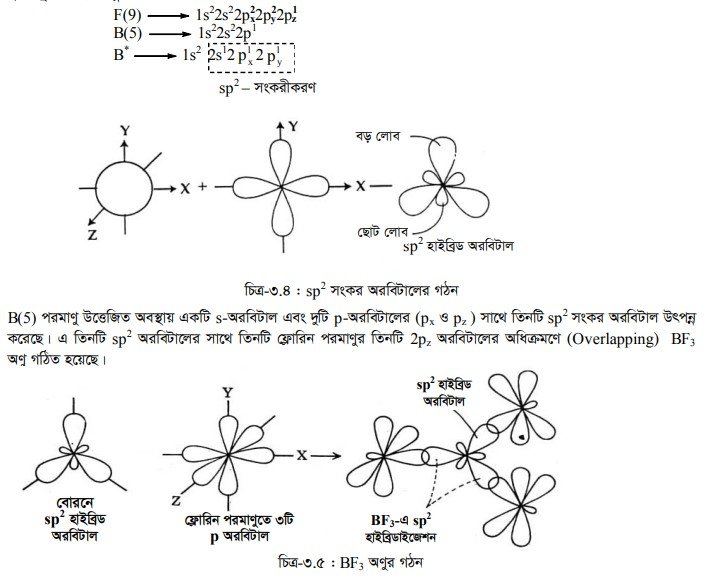
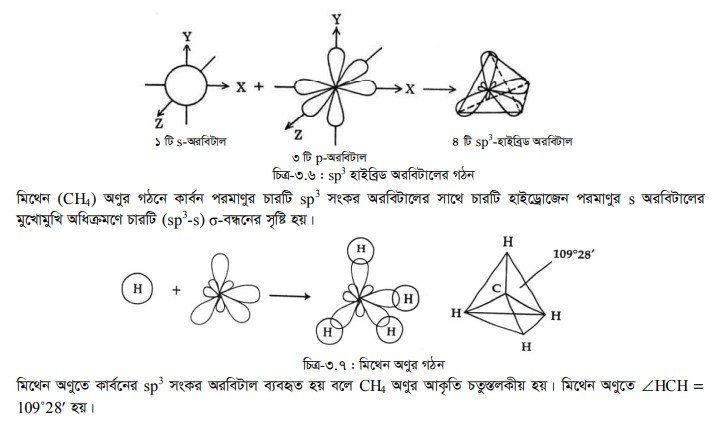
(৩) sp’ সংকর অরবিটাল : একই শক্তি স্তরের কোনো পরমাণুর একটি s-অরবিটাল ও তিনটি p-অরবিটালের মধ্যে সংকরণ ঘটলে সমশক্তি সম্পন্ন যে চারটি সংকর অরবিটাল গঠিত হয় তাকে sp3 সংকরণ বলে এবং উৎপন্ন অরবিটালকে sp3 সংকর অরবিটাল বলে। মিথেন অণুর গঠনে sp3 সংকরণ ঘটে। এক্ষেত্রে কার্বনের sp3 সংকর অরবিটাল এবং হাইড্রোজেনের s- অরবিটালের মধ্যে মুখোমুখি অধিক্রমণে চারটি (sp-s) o-বন্ধন গঠিত হয়। C(6) এর ইলেকট্রন বিন্যাস নিম্নরূপ :