d ও f ব্লক মৌলের সাধারণ ধর্মাবলি আমাদের আজকের আলোচনার বিষয়। এই পাঠটি “এইচএসসি রসায়ন ১ম পত্র” এর “পর্যায় সারণি ও মৌলের পর্যাবৃত্ত ধর্ম” ইউনিট ২ এর অন্তর্ভুক্ত
d ও f ব্লক মৌলের সাধারণ ধর্মাবলি
d-ব্লক মৌলসমূহের ধর্মাবলি
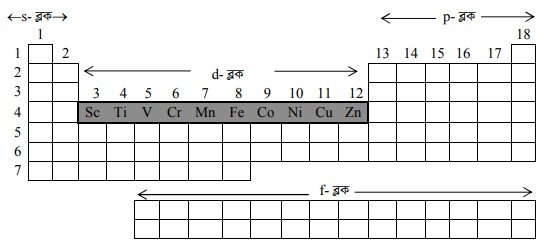
আধুনিক পর্যায় সারণিতে মৌলসমূহকে s, p, d, f-ব্লকে ভাগ করা হয়েছে। সারণির বামে s-ব্লক এবং ডানে p-ব্লক মৌলসমূহের অবস্থান। s-ব্লক এবং p ব্লক মৌলের মাঝে d-ব্লক মৌলসমূহকে জায়গা দেওয়া হয়েছে। পর্যায় সারণিতে ৪র্থ, ৫ম এবং ৬ষ্ঠ পর্যায়ে ও 3-7; গ্রুপ-8-10 এবং 11, 12 উপশ্রেণিতে এসব মৌলের অবস্থান।
পর্যায় সারণি
d-ব্লক মৌলের ইলেকট্রন বিন্যাস
যেসব মৌলের ইলেকট্রন বিন্যাসে সর্বশেষ ইলেকট্রনটি d অরবিটালে প্রবেশ করে তাদেরকে d-ব্লক মৌল বলে। d-ব্লক মৌলের সাধারণ ইলেকট্রন বিন্যাস হলো (n-1) d 10 nst । এদের সর্বশেষ দুটি স্তর ইলেকট্রন দ্বারা অপূর্ণ থাকে। একটি অরবিটালে 1-10 1-2 টি ইলেকট্রন এবং অপরটিতে 1টি বা 2টি ইলেকট্রন থাকে ।
d-ব্লক মৌলসমূহ নিম্নোক্ত 4 টি ব্লকে বিভক্ত। যথা-
3d-ব্লক বা ১ম অবস্থান্তর সিরিজ : Sc( 21 ) থেকে Zn(30)
4d-ব্লক বা ২য় অবস্থান্তর সিরিজ : Y (39) থেকে Cd( 48 )
5d-ব্লক বা ৩য় অবস্থান্তর সিরিজ : La (57), Hf(72) – Hg (80)
6d-ব্লক বা ৪র্থ অবস্থান্তর সিরিজ : Ac (89), Rf (104) – Rg (111)
প্রথম অবস্থান্তর মৌলসমূহের ভৌত ধর্ম
3d-ব্লক মৌলসমূহের কতিপয় ভৌত ধর্ম নিম্নে উল্লেখ করা হলো :
(১) ধাতব প্রকৃতি : প্রথম অবস্থান্তর মৌলসমূহ ধাতু, সাধারণ অবস্থায় কঠিন এবং বেশ শক্ত। এদের ঘনত্ব খুব বেশি এবং সকল ধাতুই তাপ ও বিদ্যুৎ সুপরিবাহী। এসব মৌলের গলনাঙ্ক এবং স্ফুটনাঙ্ক খুব বেশি। এ সিরিজের মৌলসমূহের সর্বনিম্ন গলনাঙ্ক কপারের (1083°C) এবং সর্বোচ্চ গলনাঙ্ক ভ্যানাডিয়ামের (1890°C)।
(২) জারণ অবস্থা : অবস্থান্তর মৌলসমূহের পরিবর্তনশীল জারণ অবস্থা আছে। সর্বশেষ শক্তি স্তরে দুটি অপূর্ণ স্তর থাকায় এদের জারণ অবস্থা একাধিক হয়। অবস্থান্তর মৌলসমূহে (n-1)d এবং ns দুটি অপূর্ণ শক্তি স্তর থাকায় এরা প্রথমে ns-অরবিটাল হতে ইলেকট্রন ত্যাগ করে তাই স্ক্যান্ডিয়াম ছাড়া অন্যান্য সকল মৌলের জারণ অবস্থা +2 হয়। পরবর্তীতে এসব মৌল (n-1) d-অরবিটাল হতেও ক্রমান্বয়ে ইলেকট্রন ত্যাগ করে ভিন্ন ভিন্ন জারণ অবস্থা প্রাপ্ত হয়। নিম্নে মৌলসমূহের একাধিক জারণ অবস্থা দেখানো হলো :

(৩) চুম্বকীয় ধর্ম : অবস্থান্তর ধাতুসমূহে চুম্বক ধর্ম রয়েছে। এদের পরমাণুতে d অরবিটালে অযুগ্ম ইলেকট্রন থাকায় এরা চুম্বক ক্ষেত্র দ্বারা আকর্ষিত হয়। পরমাণুর d অরবিটালে অযুগ্ম ইলেকট্রনের ঘূর্ণনের ফলে চুম্বক মোমেন্ট বা ভ্রামকের সৃষ্টি হয়। যে আয়নে যত বেশি সংখ্যক অযুগ্ম ইলেকট্রন থাকে সে আয়ন তত বেশি প্যারাচুম্বকীয় হয়। আয়রন, কোবাল্ট এবং নিকেল হলো ফেরোম্যাগনেটিক অর্থাৎ এ সকল ধাতু প্রবলভাবে চুম্বক ক্ষেত্র দ্বারা আকৃষ্ট হয়। জিঙ্ক ধাতু d অরবিটালে কোনো অযুগ্ম ইলেকট্রন থাকে না বলে চুম্বক ক্ষেত্র দ্বারা আকৃষ্ট হয় না। এ ধরনের ধাতুকে ডায়াম্যাগনেটিক বলে ।
(৪) ঘনত্ব : সাধারণভাবে d-ব্লক মৌলসমূহের ঘনত্ব পারমাণবিক সংখ্যা বৃদ্ধিতে ক্রমান্বয়ে বৃদ্ধি পেতে থাকে। যেমন, Sc(21) এর ঘনত্ব হলো 3.0g/cm’ অথচ একই পর্যায়ের Cu(29) এর ঘনত্ব হলো 8.9g/cm3। একই পর্যায়ে ক্রমান্বয়ে ধাতু ধর্ম বৃদ্ধি পায় বলে এদের ঘনত্বও বৃদ্ধি পায়।
(৫) পারমাণবিক ব্যাসার্ধ : d-ব্লক মৌলসমূহের পারমাণবিক ব্যাসার্ধ পর্যায়ে পারমাণবিক সংখ্যা বৃদ্ধিতে ধীরে ধীরে হ্রাস পায়। একই পর্যায়ে পরমাণুর নিউক্লিয়াসে প্রোটন সংখ্যার ক্রমান্বয়ে বৃদ্ধিতে পারমাণবিক ব্যাসার্ধ হ্রাস পায়। যেমন, SC(21) এর পারমাণবিক ব্যাসার্ধ হলো 1.44 Å অথচ টাইটেনিয়ামের 1.32 Å । আবার Mn(25) এর 1.17 Å ।
d-ব্লক মৌলসমূহের রাসায়নিক ধর্ম
d-ব্লক মৌলসমূহের রাসায়নিক ধর্ম ব্যাপক তবে এখানে গুরুত্বপূর্ণ কতিপয় ধর্ম বর্ণনা করা হলো :
(১) প্রভাবক হিসেবে অবস্থান্তর মৌল : প্রভাবক হিসেবে অবস্থান্তর মৌলসমূহ এবং এদের যৌগসমূহ ব্যবহৃত হয় “প্রভাবক হলো কতিপয় রাসায়নিক পদার্থ যার উপস্থিতিতে রাসায়নিক বিক্রিয়ার গতিবেগ বৃদ্ধি বা হ্রাস পায়।” Pt, Ni, Cr, Fe, Cr ইত্যাদি মৌল এবং V2Os, MnO2 যৌগ রাসায়নিক বিক্রিয়ায় প্রভাবক হিসেবে ক্রিয়া করে। যেমন-


(২) অবস্থান্তর মৌলসমূহের জটিল যৌগ গঠন : অবস্থান্তর ধাতব পরমাণুর একটি অন্যতম বৈশিষ্ট্য হলো এরা অন্য কোনো অণু বা আয়ন বা পরমাণুর সাথে যুক্ত হয়ে জটিল যৌগ গঠন করতে পারে। ধাতব পরমাণুর ফাঁকা d অরবিটালে নিঃসঙ্গ ইলেকট্রনের অধিকারী অণু বা পরমাণু বা আয়ন তাদের নিঃসঙ্গ ইলেকট্রন জোড় দ্বারা সন্নিবেশ বন্ধনের মাধ্যমে যুক্ত হয়ে জটিল যৌগ গঠন করে। সন্নিবেশ বন্ধনে অংশ গ্রহণকারী এসব অণু বা আয়ন বা পরমাণুকে লিগাল্ড বলে। লিগান্ড হচ্ছে ঋণাত্মক আয়ন বা নিরপেক্ষ অণু যারা অবস্থান্তর মৌলের সাথে সন্নিবেশ বন্ধনে আবদ্ধ হয়ে জটিল আয়ন তৈরি করে। লিগান্ডগুলো ইলেকট্রন দাতা বা গ্রুপ হিসেবে কাজ করে।
যেমন— NH3, H2O হলো লিগাল্ড ।
অবস্থান্তর ধাতুসমূহের ক্ষুদ্র আয়তনের কারণে এদের চার্জের ঘনত্ব অনেক বেশি। উচ্চ ধনাত্মক চার্জের কারণে এরা লিগাল্ড হতে ইলেকট্রন জোড় গ্রহণ করতে পারে । প্রত্যেকটি অবস্থান্তর মৌলের সিরিজে জটিল যৌগের স্থায়িত্ব মৌলের (পর্যায়ে) পারমাণবিক সংখ্যা বৃদ্ধিতে পরমাণুর আকার হ্রাসের কারণে বৃদ্ধি পায় । d-ব্লক মৌলের একাধিক জারণ অবস্থা প্রদর্শন করলে সর্বোচ্চ জারণ সংখ্যা সংবলিত জটিল যৌগের স্থায়িত্ব সর্বাধিক হবে। যেমন— NH3 এর সাথে Co2+ স্থিতিশীল যৌগ গঠন করে না অথচ Cot সহজেই NH3 এর সাথে স্থিতিশীল [Co(NH3)gl3+ জটিল আয়ন গঠন করে। জটিল আয়নে লিগাল্ড সংখ্যাকে সন্নিবেশ সংখ্যা বলে। কোন কোন মেটাল কয়টি লিগাল্ড ধরবে তা আমাদের জানতে হয়।
যেমন—
Fe2+ এর সন্নিবেশ সংখ্যা 6
Cost এর সন্নিবেশ সংখ্যা 6
সন্নিবেশ সংখ্যা 6 হলে জটিল আয়নটি অষ্টকতলীয় হবে আবার 5 হলে ত্রিভুজাকার পিরামিডীয় হবে, 4 হলে সমতলীয় বর্গাকার বা চতুস্তলকীয় হবে এবং 2 হলে সরলরৈখিক হবে।
লিগান্ডগুলো দুই ধরনের হয়। যথা— সবল ও দুর্বল। সবল লিগান্ড দ্বারা জটিল আয়ন গঠনের সময় d-অরবিটাল ইলেকট্রনগুলো paired up হবে এবং লিগান্ডগুলো d-ব্লক মৌলের সাথে সন্নিবেশ বন্ধনে আবদ্ধ হবে। অপরদিকে দুর্বল লিগান্ডগুলো যুক্ত হওয়ার সময় d-অরবিটাল ইলেকট্রনগুলো paired up হয় না। জটিল আয়ন গঠনে যদি d অরবিটাল-এ অযুগ্ম (unpaired) ইলেকট্রন থাকে তাহলে আয়নটি প্যারাম্যাগনেটিক হবে এবং যদি অযুগ্ম (unpaired) ইলেকট্রন না থাকে তাহলে ডায়াম্যাগনেটিক ধর্ম প্রকাশ করবে।
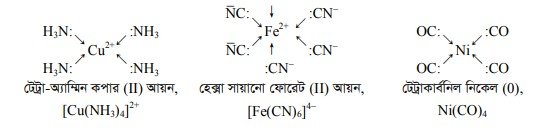
জটিল আয়ন লেখার সময় প্রথমে কেন্দ্রীয় পরমাণু, এরপর অ্যানায়ন লিগাল্ড ও শেষে নিরপেক্ষ লিগান্ড লিখতে হয়।
জটিল আয়ন নামকরণের সময় প্রথমে লিগান্ডের নাম ও সংখ্যা এবং শেষে ধনাত্মক জটিল আয়নের সময় কেন্দ্রীয় পরমাণুর ইংলিশ নাম ও জারণ সংখ্যা উল্লেখ করতে হয়। ঋণাত্মক জটিল আয়নের সময় কেন্দ্রীয় পরমাণুর ল্যাটিন নামের সাথে অ্যাট ও জারণ সংখ্যা উল্লেখ করতে হয়। ঋণাত্মক লিগান্ডগুলোর সাথে ওকার যুক্ত হয়। যেমন- ক্লোরো (CI), সায়ানো (CN), নাইট্রো (NO2), থায়োসায়ানেটো (SCN), সালফেটো (SO 2 ) ইত্যাদি। নিরপেক্ষ লিগান্ড যেমন পানিকে অ্যাকুয়া, অ্যামোনিয়াকে অ্যাম্মিন, কার্বন মনোঅক্সাইডকে কার্বনিল ইত্যাদি লিখতে হয়।
৩) অবস্থান্তর মৌলসমূহের রঙিন যৌগ গঠন : অবস্থান্তর মৌলসমূহের যৌগগুলো সাধারণত রঙিন হয়। Sc(21) এবং Zn(30) এর যৌগগুলো বর্ণহীন হয়। Sc(21) এর স্থিতিশীল আয়নে d অরবিটালে কোন ইলেকট্রন থাকে না আবার Zn(30) এর স্থিতিশীল আয়নে d- অরবিটাল ইলেকট্রন দ্বারা পূর্ণ থাকে। অবস্থান্তর মৌলের প্রথম সিরিজে Ti(22) থেকে Cu(29) পর্যন্ত মৌলগুলোর স্থিতিশীল আয়নে d-অরবিটাল ইলেকট্রন দ্বারা আংশিক পূর্ণ থাকে তাই এসব আয়নে শক্তি শোষণের ফলে d অরবিটালের ইলেকট্রনের d-d স্থানান্তর (Transition) ঘটে।
অর্থাৎ শক্তি শোষণের ফলে d- অরবিটালের নিম্ন শক্তিস্তরে অবস্থিত ইলেকট্রনসমূহে একই d-অরবিটালের উচ্চ শক্তিস্তরে গমন করে। এ শোষিত শক্তি যদি দৃশ্যমান অঞ্চলের আলোর নির্দিষ্ট তরঙ্গদৈর্ঘ্যের হয় তবে শোষিত আলোর অবশিষ্ট তরঙ্গদৈর্ঘ্যের রং আমাদের চোখে প্রতিফলিত হয়। আয়ন যে বর্ণের আলো শোষণ করে তার সম্পূরক বর্ণের আলো দৃশ্যমান হয়। যেমন— যদি আয়ন সবুজ বর্ণ শোষণ করে তবে দ্রবণের বর্ণ বেগুনি লাল হয়। আবার নীল বর্ণের আলো শোষণ করলে দ্রবণের বর্ণ হলুদ হয় ।

যদি আপতিত রশ্মির পুরোটাই কোনো বস্তু কর্তৃক শোষিত হয় কিন্তু শোষিত আলোকরশ্মির কোনো অংশই বিকিরিত হয় না তবে ঐ বস্তুর বর্ণ কালো হয়। আবার যদি বস্তু কর্তৃক শোষিত আলোকরশ্মির পুরোটাই প্রতিফলিত হয় তবে বস্তুটিকে বর্ণহীন দেখায়। যদি একমাত্র নির্দিষ্ট তরঙ্গদৈর্ঘ্যের আপতিত আলোকরশ্মি বস্তু শোষণ করে তবেই বস্তুটি বৈশিষ্ট্যপূর্ণ বর্ণ দেখাবে।
ল্যান্থানাইড সংকোচন ( Lanthanide Contraction) :
ল্যান্থানাইড মৌলগুলোর ক্ষেত্রে দেখা যায়, পারমাণবিক সংখ্যা বাড়ার সাথে পারমাণবিক ব্যাসার্ধ কমতে থাকে বা কখনো কখনো সমান থাকে । ল্যান্থানাইড মৌলগুলোর এ ধরনের পারমাণবিক ব্যাসার্ধের কমে যাওয়ার ঘটনাকে ল্যান্থানাইড সংকোচন বলা হয় । ল্যান্থানাইড মৌলে পারমাণবিক ব্যাসার্ধ ও আয়নিক ব্যাসার্ধের তালিকা :

ল্যান্থানাইড মৌলগুলোর ক্ষেত্রে 6s উপস্তরে ইলেকট্রন প্রবেশের পর 4f উপস্তরে এক এক করে ইলেকট্রন প্রবেশ করে। পরমাণুর পারমাণবিক সংখ্যা বাড়ার সাথে সাথে 4f উপস্তরে ইলেকট্রন প্রবেশের ফলে মৌলগুলোর পারমাণবিক সংখ্যা এক এক করে বাড়তে থাকে। কিন্তু 4f উপস্তরের ইলেকট্রনগুলোর আবরণী ক্ষমতা বা আচ্ছাদন প্রভাব কম হওয়ার জন্য নিউক্লিয়াসের ধনাত্মক আধান বাড়ার কারণে বহিস্থ ইলেকট্রনের উপর নিউক্লিয়াসের আকর্ষণ বল ধীরে ধীরে বেড়ে যায়। (f-উপস্তরের আবরণী প্রভাব সবচেয়ে কম, s >p > d > f)। এজন্য ল্যান্থানাইড মৌলগুলোর পারমাণবিক সংখ্যা বাড়ার সাথে সাথে পারমাণবিক ব্যাসার্ধ ও আয়নিক ব্যাসার্ধের সংকোচন ঘটে।
মনে রাখবেন : বহু ইলেকট্রনবিশিষ্ট মৌলের ক্ষেত্রে ভিতরের কক্ষের ঘূর্ণায়মান ইলেকট্রন, সর্ববহিঃস্থ কক্ষের ইলেকট্রনের উপর একটি পর্দার মতো কাজ করে। এজন্য নিউক্লিয়াসের আধান ভিতরের কক্ষের ইলেকট্রন পর্দার প্রভাবে সর্ববহিঃস্থ কক্ষের ইলেকট্রনের উপরে সর্বাধিক বল প্রয়োগ করতে পারে না। এ প্রভাব ভিতরের কক্ষের ইলেকট্রন দ্বারা বাইরের কক্ষের ইলেকট্রনের উপর আবরণী প্রভাব বা আচ্ছাদন প্রভাব বলা হয়। সব কক্ষের ইলেকট্রনের আবরণী ক্ষমতা সমান নয়। বিভিন্ন কক্ষের আবরণী ক্ষমতার ক্রম s>p>d>f
আক্টিনাইড সংকোচন (Contraction of Actinides) : অ্যাক্টিনাইড মৌলগুলোর ক্ষেত্রে দেখা যায়, পরমাণু ক্রমাঙ্কের বাড়ার সাথে পারমাণবিক ব্যাসার্ধ কমতে থাকে। অ্যাক্টিনাইড মৌলগুলোর এ ধরনের পারমাণবিক ব্যাসার্ধ কমে যাওয়ার ঘটনাকে অ্যাক্টিনাইড সংকোচন বলা হয় । অ্যাক্টিনাইড মৌলগুলোর ক্ষেত্রে 7s উপস্তরে ইলেকট্রন পূর্ণ করে 5f উপস্তরে এক এক করে ইলেকট্রন প্রবেশ করে। পরমাণুর পারমাণবিক সংখ্যা বাড়ার সাথে সাথে 5f উপস্তরে ইলেকট্রন প্রবেশের ফলে মৌলগুলোর পারমাণবিক সংখ্যা এক এক করে বাড়তে থাকে কিন্তু 5f উপস্তরের ইলেকট্রনগুলোর আবরণী ক্ষমতা বা আচ্ছাদন প্রভাব কম হওয়ার জন্য নিউক্লিয়াসের ধনাত্মক আধান বাড়ার কারণে বহিস্থ ইলেকট্রনের উপর নিউক্লিয়াসের আকর্ষণ বল ধীরে ধীরে বেড়ে যায়। f-উপস্তরের আবরণী প্রভাব সবচেয়ে কম, s > p > d > f। এজন্য অ্যাক্টিনাইড মৌলগুলোর পারমাণবিক সংখ্যা বাড়ার সাথে সাথে পারমাণবিক ব্যাসার্ধ ও আয়নিক ব্যাসার্ধের সংকোচন ঘটে।
মনে রাখবেন : কোনো পরমাণুর আয়নের নিউক্লিয়াস থেকে আয়নিক বন্ধনের যে পর্যন্ত আয়নটির প্রভাব বর্তমান থাকে সে কার্যকরী দূরত্বকে আয়নিক ব্যাসার্ধ বলে। পরমাণু অপেক্ষা পরমাণু থেকে উৎপন্ন ক্যাটায়নের ব্যাসার্ধ ছোট হয়। বিপরীতভাবে পরমাণু অপেক্ষা পরমাণু থেকে উৎপন্ন অ্যানায়নের ব্যাসার্ধ বড় হয়। ক্যাটায়নের আধান যত বেশি হয় আয়নিক ব্যাসার্ধ তত ছোট হয়। অ্যানায়নের আধান মাত্রা যত বেশি হয় আয়নিক ব্যাসার্ধ তত বড় হয় ।
