অজৈব যৌগের নামকরণ আমাদের আজকের আলোচনার বিষয়। এই পাঠটি “এইচএসসি রসায়ন ১ম পত্র” এর “রাসায়নিক বন্ধন” ইউনিট ৩ এর অন্তর্ভুক্ত।
Table of Contents
অজৈব যৌগের নামকরণ
অজৈব যৌগের নামকরণ :
অজৈব যৌগের নামকরণের ইতিহাস (History of Nomenclature of Inorganic Compounds ) :
অতি প্রাচীনকালে রসায়নবিদগণ যৌগের নামকরণের ক্ষেত্রে সংশ্লিষ্ট যৌগের ইতিহাসের উপর নির্ভর করতেন, সে যৌগটি জৈব যৌগ হোক আর অজৈব যৌগ হোক। যেমন আলকেমী জাবীর ইবনে হাইয়ান অষ্টম শতাব্দীতে গ্রিন ভিট্রিওলকে পাতন করে যে গ্যাস পেয়েছিলেন তাকে পানিতে দ্রবীভূত করে সালফিউরিক এসিড প্রস্তুত করেন। এ এসিডটি দেখতে তেলের মতো এবং গ্রিন ভিট্রিওল থেকে উৎপন্ন বলে তিনি এর নাম দেন ওয়েল অব ভিট্রিওল (Oil of vitriol)।
ঊনবিংশ শতাব্দীতে অজৈব যৌগের সংখ্যা ছিল কম। কম সংখ্যক অজৈব যৌগের নামকরণ করাটা তত কঠিন ছিল না। কম সংখ্যক অজৈব যৌগকে তাদের প্রাপ্তির ইতিহাসের উপর নির্ভর করেই করা যেত। বর্তমানের প্রেক্ষাপট ভিন্ন। অজৈব যৌগের সংখ্যা অনেক অনেক বেশি হওয়ায় এদের নামকরণের ক্ষেত্রে সুনির্দিষ্ট নিয়ম অনুসরণ করার প্রয়োজনীয়তা দেখা দেয়। এরই ধারাবাহিকতায় বিভিন্ন অজৈব যৌগের নামকরণের বিভিন্ন নিয়ম আলোচনা করা হলো—
ক্যাটায়নের নামকরণ (Nomenclature of Cations )
১. মনোএটোমিক ক্যাটায়ন : মনোএটোমিক ক্যাটায়ন যেমন M”+ প্রকৃতির ক্যাটায়নসমূহের নামকরণের ক্ষেত্রে, সংশ্লিষ্ট ধাতু + রোমান পদ্ধতিতে চার্জ বা আধান সংখ্যা + আয়ন।
এখানে, M = ধাতুর প্রতীক, n = ধাতুর আধান সংখ্যা
যেমন Na+ = সোডিয়াম (I) আয়ন,
K’ = পটাসিয়াম (I) আয়ন,
Ca2+ = ক্যালসিয়াম (II) আয়ন,
Cu2+ = কপার (II) আয়ন,
Fe2+ = আয়রন (II) আয়ন,
Fe3+ = আয়রন (III) আয়ন,
Al+ = অ্যালুমিনিয়াম (III) আয়ন ইত্যাদি।
২. পলিএটোমিক ক্যাটায়ন : পলিএটোমিক ক্যাটায়নের নামকরণের ক্ষেত্রে, সংশ্লিষ্ট ক্যাটায়নের শব্দমূল (Steam) + অনিয়াম (Onium) + আয়ন । এ নিয়ম অনুসরণ করা হয়। যেমন IH) (আয়োডোনিয়াম আয়ন), SH; (সালফোনিয়াম আয়ন), AsH (আর্সেনিয়াম আয়ন) ইত্যাদি।
আরও বেশ কিছু পলিএটোমিক ক্যাটায়ন যাদের নামকরণও প্রচলিত সাধারণ পদ্ধতি অনুসরণ করা হয়। যেমন HOT (হাইড্রোনিয়াম আয়ন), NH, (অ্যামোনিয়াম আয়ন), PH, (ফসফোনিয়াম আয়ন) ইত্যাদি।
অ্যানায়নসমূহের নামকরণ (Nomenclature of Anions )
১. মনোএটোমিক অ্যানায়ন : মনোএটোমিক অ্যানায়ন যেমন A” প্রকৃতির অ্যানায়নসমূহের নামকরণের ক্ষেত্রে, সংশ্লিষ্ট অ্যানায়নের শব্দমূল (Steam) + আইড (-ide) + আয়ন ।
এখানে, A = অধাতব মৌলের প্রতীক এবং n = মৌলের চার্জ বা আধান সংখ্যা ।
যেমন H (হাইড্রাইড আয়ন), O2 (অক্সাইড আয়ন), S2 (সালফাইড আয়ন), N’— (নাইট্রাইড আয়ন), P± (ফসফাইড আয়ন), Se2 (সেলিনাইড আয়ন) ইত্যাদি।
২. পলিএটোমিক অ্যানায়ন : পলিএটোমিক অ্যানায়নের নামকরণের ক্ষেত্রে একটু ভিন্নতর নিয়ম অনুসরণ করা হয়। বেশ কিছু পলিএটোমিক অ্যানায়ন রয়েছে যাদের নামের শেষে আইড (−ide) যুক্ত করে নামকরণ করা হয়। যেমন OH (হাইড্রোক্সাইড আয়ন), SH (হাইড্রোজেন সালফাইড আয়ন), NH2 (অ্যামাইড আয়ন), CN (সায়ানাইড আয়ন), NH2 (ইমাইড আয়ন), N3 (অ্যাজাইড আয়ন), O2 (সুপার অক্সাইড আয়ন), O3 (ওজোনাইড আয়ন), S2 (ডাই সালফাইড আয়ন), I, (ট্রাই আয়োডাইড আয়ন), HF 2 (হাইড্রোজেন ডাইফ্লোরাইড আয়ন) ইত্যাদি।
৩. অক্সিজেনযুক্ত পলিএটোমিক অ্যানায়ন : অক্সিজেনযুক্ত পলিএটোমিক অ্যানায়নসমূহের নামকরণের ক্ষেত্রে সংশ্লিষ্ট অ্যানায়নের 2- নামের শেষে আইট (−ite) যুক্ত করা হয়। যেমন NO2 (নাইট্রাইট আয়ন), SO3 (সালফাইট আয়ন), CIO2 (ক্লোরাইট 3- আয়ন), CIO (হাইপো ক্লোরাইট আয়ন), IO (হাইপো আয়োডাইট আয়ন), AsO (আর্সেনাইট আয়ন), S2O (ডাই সালফাইট আয়ন) ইত্যাদি।
দ্বি-মৌল যৌগের নামকরণ (Nomenclature of Binary Compounds) : মাত্র দুটি মৌলের সমন্বয়ে গঠিত যৌগই দ্বি-মৌল যৌগ নামে পরিচিত। দ্বি-মৌল যৌগের নামকরণের ক্ষেত্রে বেশ কিছু সাধারণ নিয়ম অনুসরণ করা হয়। যেমন—
১. দ্বি-মৌল যৌগের নামকরণের ক্ষেত্রে যৌগের অণুতে বিদ্যমান যে মৌলটির তড়িৎ ঋণাত্মকতার মান কম তার নাম + পরবর্তী মৌলের শব্দমূল + আইড (−ide) এ নিয়ম অনুসরণ করা হয়। উদাহরণস্বরূপ Ca3N2 (ক্যালসিয়াম নাইট্রাইড), Mg3N2 (ম্যাগনেসিয়াম নাইট্রাইড), AIN (অ্যালুমিনিয়াম নাইট্রাইড), NaCl (সোডিয়াম ক্লোরাইড), CaCl (ক্যালসিয়াম ক্লোরাইড) ইত্যাদি।
২. হাইড্রোজেনবিশিষ্ট দ্বি-মৌল যৌগের নামকরণের ক্ষেত্রে নিচের নিয়ম অনুসরণ করা হয়। এক্ষেত্রে সংশ্লিষ্ট দ্বি-মৌল যৌগে বর্তমান হাইড্রোজেন ভিন্ন অন্য মৌলের পরমাণু + হাইড্রো + আইড (−ide) এ নিয়ম অনুসরণ করা হয়। যেমন CaH, (ক্যালসিয়াম হাইড্রাইড), NaH (সোডিয়াম হাইড্রাইড), LiH (লিথিয়াম হাইড্রাইড), BH3 (বোরন হাইড্রাইড) ইত্যাদি।
৩. বেশ কিছু দ্বি-মৌল যৌগ দ্রবণে এসিডের ন্যায় আচরণ করে, তাদের নামকরণের ক্ষেত্রে হাইড্রো + অন্তর্ভুক্ত মৌল + ইক অথবা হাইড্রোজেন + অন্তর্ভুক্ত মৌল + আইড এ নিয়ম অনুসরণ করা হয়। যেমন HF (হাইড্রোফ্লোরিক এসিড বা হাইড্রোজেন ফ্লোরাইড), HCl (হাইড্রোক্লোরিক এসিড বা হাইড্রোজেন ক্লোরাইড), N3H (হাইড্রোজোয়িক এসিড বা হাইড্রোজেন অ্যাজাইড), H2S (হাইড্রোজেন সালফাইড) ইত্যাদি।
৪. আবার কিছু দ্বি-মৌল যৌগ আছে যাদের নামকরণ সাধারণ বা প্রচলিত নিয়ম অনুসারেই করা হয়। যেমন NH3 (অ্যামোনিয়া), PH3 (ফসফিন), H2O (পানি), AsH3 (আরসিন), NH2NH2 (হাইড্রাজিন বা ডাইঅ্যামিন) ইত্যাদি।
অক্সি-এসিডসমূহের নামকরণ (Nomenclature of Oxy- Acids) : অক্সি-এসিডসমূহ সাধারণত হাইড্রোজেন, অক্সিজেন ও অপর একটি তৃতীয় অধাতব মৌলের সমন্বয়ে গঠিত। এসব যৌগের নামকরণের ক্ষেত্রে নিচের শর্তসমূহ অনুসরণ করা হয়ে থাকে :
১. যেসব অক্সি-এসিডের মধ্যে তৃতীয় অধাতব মৌলের জারণ মান তুলনামূলকভাবে কম তাদের নামকরণের ক্ষেত্রে নিচের নিয়ম অনুসরণ করা হয়।


৫. অধাতব মৌলের অক্সাইডের অণুতে পানির যুক্ত হওয়ার উপর ভিত্তি করে এদের নামকরণ করা হয়ে থাকে। অক্সাইডের সাথে বেশি সংখ্যক পানির অণুর সংযোজন ঘটলে মূল এসিডের নামের পূর্বে অর্থো, কম পানির অণুর সংযোজন ঘটলে মেটা এবং এ দুয়ের মাঝামাঝি সংখ্যায় পানির অণুর সংযোজন ঘটলে পাইরো শব্দ যুক্ত করে নামকরণ করা হয়। যেমন P2Os এর সাথে বিভিন্ন সংখ্যক পানির অণুর সংযোজনের মাধ্যমে উৎপন্ন এসিডের নামকরণ নিচে উল্লেখ করা হলো :

জটিল যৌগের নামকরণ
জটিল আয়ন নামকরণের সময় প্রথমে লিগান্ডের নাম ও সংখ্যা এবং শেষে ধনাত্মক জটিল আয়নের সময় কেন্দ্রীয় পরমাণুর ইংলিশ নাম ও জারণ সংখ্যা উল্লেখ করতে হয়। ঋণাত্মক জটিল আয়নের সময় কেন্দ্রীয় পরমাণুর ল্যাটিন নামের সাথে -অ্যাট ও জারণ সংখ্যা উল্লেখ করতে হয়। ঋণাত্মক লিগান্ডগুলোর সাথে ওকার যুক্ত হয়। যেমন- ক্লোর (CI), সায়ানো (CN), নাইট্রো (NO2), থায়োসায়ানেটো (SCN), সালফেটো (SO 2 ) ইত্যাদি। নিরপেক্ষ লিগাল্ড যেমন পানিকে অ্যাকুয়া, অ্যামোনিয়াকে অ্যাম্মিন, কার্বন মনোঅক্সাইডকে কার্বনিল ইত্যাদি লিখতে হয়। নিম্নে কয়েকটি জটিল আয়নের নামকরণ দেওয়া হলো ।
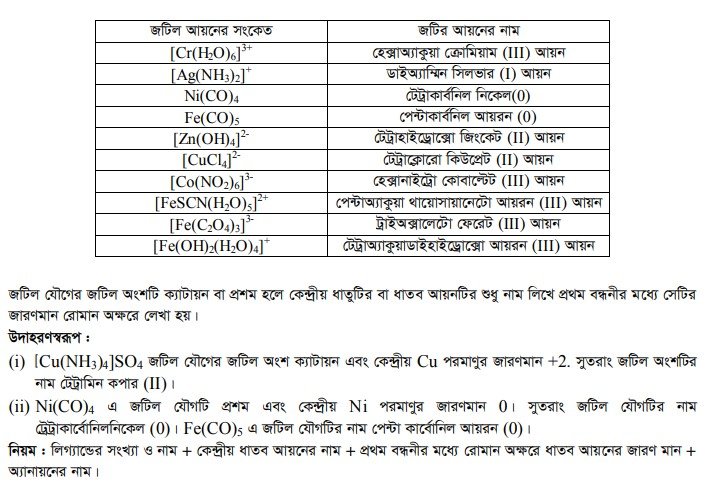
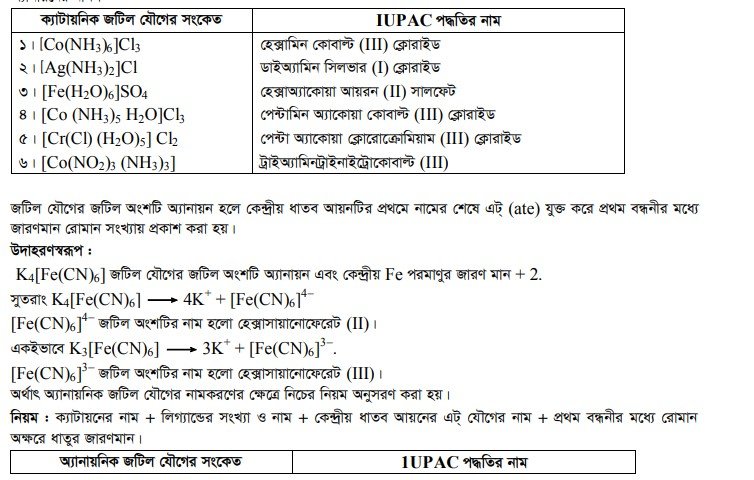
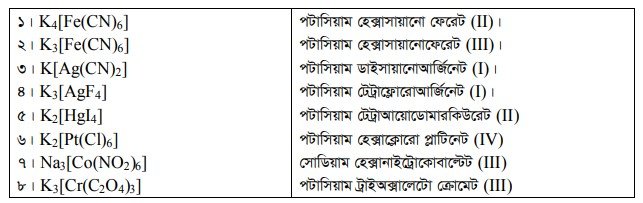
আরও পড়ুন…

