অণুর আকৃতি ও বন্ধন কোণের উপর মুক্ত জোড় ইলেকট্রনের প্রভাব আমাদের আজকের আলোচনার বিষয়। এই পাঠটি “এইচএসসি রসায়ন ১ম পত্র” এর “রাসায়নিক বন্ধন” ইউনিট ৩ এর অন্তর্ভুক্ত।
অণুর আকৃতি ও বন্ধন কোণের উপর মুক্ত জোড় ইলেকট্রনের প্রভাব
অণুর গঠনের ক্ষেত্রে নিঃসঙ্গ ইলেকট্রন জোড়ের ভূমিকা :
অণুর গঠনের ক্ষেত্রে নিঃসঙ্গ ইলেকট্রন জোড়ের ভূমিকা অপরিসীম। এ প্রেক্ষিতে NH3 অণুর গঠন সম্পর্কে আলোচনা করা যাক । NH3 অণুতে নাইট্রোজেন পরমাণুর sp3 সংকরায়ণ ঘটলেও HNH বন্ধন কোণের মান 107° হয়। কারণ NH3 অণুতে একটি মুক্ত জোড় বা নিঃসঙ্গ ইলেকট্রন জোড় এর উপস্থিতি। NH3 অণুর কেন্দ্রীয় পরমাণু N এর পারমাণবিক সংখ্যা 7।
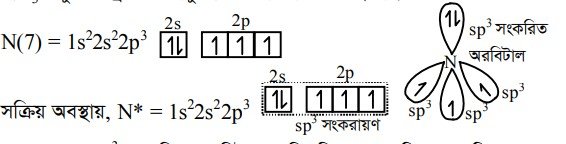
N পরমাণুর sp সংকরিত অরবিটালের তিনটির প্রত্যেকটিতে একটি করে অযুগ্ম ইলেকট্রন এবং একটিতে জোড় ইলেকট্রন অবস্থান করে। N পরমাণু তিনটি sp সংকরিত অরবিটালের অযুগ্ম ইলেকট্রনের সাথে হাইড্রোজেন পরমাণু s-অরবিটালের অযুগ্ম ইলেকট্রন অধিক্রম করে NH3 অণুর গঠন কাঠামো সৃষ্টি করে । সংকরিত অরবিটালের জোড় ইলেকট্রন নিঃসঙ্গ ইলেকট্রন জোড় হিসাবে অবস্থান করে।
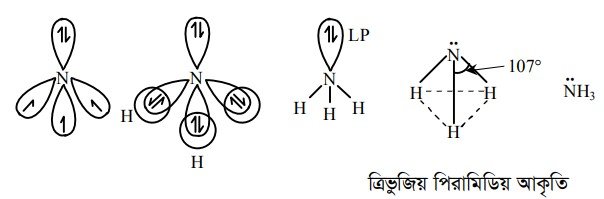
নিঃসঙ্গ ইলেকট্রন জোড় – বন্ধন ইলেকট্রন জোড় (LP – B-P) বিকর্ষণ বল, বন্ধন ইলেকট্রন জোড় – বন্ধন ইলেকট্রন জোড় (B-P — B-P) বিকর্ষণ বল অপেক্ষা বেশি হওয়ায় অর্থাৎ (L.P – B-P) বিকর্ষণ বল > (B-P – B-P) বিকর্ষণ বল হওয়ায় HNH বন্ধন কোণের মান 109.5° থেকে হ্রাস পেয়ে 107° হয়।
H2O অণুতে অক্সিজেন পরমাণুর sp3 সংকরায়ণ ঘটলেও H – 0 – H বন্ধন কোণের মান 104.5° হয়। কারণ H2O অণুতে দুটি মুক্ত জোড় ইলেকট্রনের উপস্থিতি।

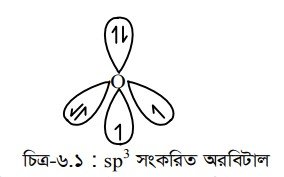
অক্সিজেন পরমাণুর সংকরিত অরবিটালের দুটি অযুগ্ম ইলেকট্রনের সাথে দুটি হাইড্রোজেন পরমাণুর s-অরবিটালের অযুগ্ম ইলেকট্রন অধিক্রমণ করে H2O অণুর গঠন কাঠামো সৃষ্টি করে ।
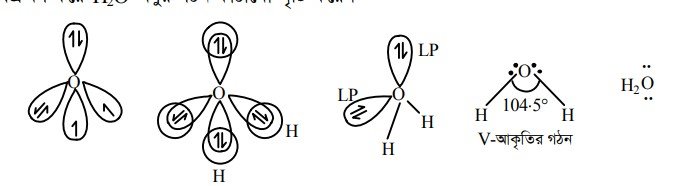
H2O অণুতে নিঃসঙ্গ ইলেকট্রন জোড়–নিঃসঙ্গ ইলেকট্রন জোড় (L.P – L.P) বিকর্ষণ বল অপর দুটি বিকর্ষণ বল নিঃসঙ্গ ইলেকট্রন জোড়—বন্ধন ইলেকট্রন জোড় (L.P – B-P) ও বন্ধন ইলেকট্রন জোড়–বন্ধন ইলেকট্রন জোড় (B.P – B-P) বিকর্ষণ বল অপেক্ষা অধিক শক্তিশালী। অর্থাৎ (L.P – L.P) বিকর্ষণ বল > (L.P – B.P) বিকর্ষণ বল > (B.P – B-P) বিকর্ষণ বল। এ কারণে H2O অণুতে H–0—H বন্ধন কোণের মান 109.5° হতে হ্রাস পেয়ে 104.5° হয়।
H2O অণুতে H –0 – H বন্ধন কোণের মান 104.5° হলেও H2S অণুতে H –S –H বন্ধন কোণের মান 92.12° হয়।
HÖ ও HS উভয় অণুর গঠন কাঠামো হতে দেখা যায়। উভয় অণুতেই ২টি নিঃসঙ্গ -ইলেকট্রন জোড় বর্তমান। উভয় অণুতে ২টি করে নিঃসঙ্গ -ইলেকট্রন জোড় থাকা সত্ত্বেও H2O অণুতে H–O – H বন্ধন কোণের মান 104.50, কিন্তু H2S অণুতে H –S— H বন্ধন কোণের মান অস্বাভাবিকভাবে কমে গিয়ে 92.12° হয়। কারণ H2S অণুর কেন্দ্রীয় পরমাণু S-এর যোজ্যতাস্তরে শূন্য 3d অরবিটাল থাকায় নিঃসঙ্গ জোড় – নিঃসঙ্গ জোড় (L.P.–L.P) বিকর্ষণ বলের প্রভাবে বন্ধন কোণের সংকোচনের মাত্রা এক্ষেত্রে H2O অণুর সাপেক্ষে যথেষ্ট বেশি হয়। ফলে H—SH বন্ধন কোণের মান অস্বাভাবিকভাবে কমে গিয়ে 92.12° হয়।
NH3 অণুতে H –NH বন্ধন কোণের মান 107° হলেও PH3 অণুতে H –PH বন্ধন কোণের মান 94° হয়।
NH3 ও PH, উভয় অণুর গঠন কাঠামো হতে দেখা যায়, উভয় অণুতেই একটি করে নিঃসঙ্গ -ইলেকট্রন জোড় থাকা সত্ত্বেও NH3 অণুতে H—N –H বন্ধন কোণের মান 107°, কিন্তু PH, অণুতে HP –H বন্ধন কোণের মান 94° হয়। কারণ PH3 অণুর কেন্দ্রীয় পরমাণু P-এর যোজ্যতাস্তরে শূন্য 3d অরবিটাল থাকায় নিঃসঙ্গ জোড় – বন্ধন জোড় (L.PB.P) বিকর্ষণ বলের প্রভাবে বন্ধন কোণের সংকোচনের মাত্রা NH3 অণুর অপেক্ষা যথেষ্ট অধিক হয়। ফলে PH3 অণুতে H–P –H বন্ধন কোণের মান অস্বাভাবিকভাবে কমে গিয়ে 94° হয়।
আরও পড়ুন…

