s ও p ব্লক মৌলের সাধারণ ধর্মাবলি আমাদের আজকের আলোচনার বিষয়। এই পাঠটি “এইচএসসি রসায়ন ১ম পত্র” এর “পর্যায় সারণি ও মৌলের পর্যাবৃত্ত ধর্ম” ইউনিট ২ এর অন্তর্ভুক্ত
Table of Contents
s ও p ব্লক মৌলের সাধারণ ধর্মাবলি
s ব্লক মৌলের প্রকৃতিতে অবস্থান (Occurance of s block elements in nature):
s ব্লক মৌলের অন্তর্ভুক্ত ক্ষার ধাতু ও মৃৎক্ষার ধাতু উভয়ই অতিশয় সক্রিয় বলে প্রকৃতিতে এদের মুক্ত অবস্থায় পাওয়া যায় না। এদেরকে যৌগ অবস্থায় বিশেষ করে ক্ষার ধাতুর অক্সাইড, হ্যালাইড ও সিলিকেট হিসাবে এবং মৃৎক্ষার ধাতুগুলোকে কার্বনেট, সালফেট, ফসফেট ও সিলিকেট হিসাবে পাওয়া যায় ।
ক্ষার ধাতুর মধ্যে প্রকৃতিতে সোডিয়াম (Na) এর পরিমাণ প্রায় 2-83% যার অবস্থান প্রাপ্তির দিক থেকে সপ্তম। পটাসিয়াম (K) এর পরিমাণ 2-59% যার অবস্থান প্রাপ্তির দিক থেকে অষ্টম। ভূত্বকের ওজন হিসাবে ক্যালসিয়াম (Ca) এর অবস্থান ৫ম ও ম্যাগনেসিয়াম (Mg) এর অবস্থান ৬ষ্ঠ।
ভূত্বকের সোডিয়াম (Na) এবং পটাসিয়াম (K) এর পরিমাণ প্রায় কাছাকাছি হলেও সমুদ্রের পানিতে NaCl এর পরিমাণ 2-8%। সমুদ্রের পানিতে পটাসিয়াম (K) এর পরিমাণ মাত্র 0.৪%। কারণ দ্রবীভূত আকরিক থেকে ভূগর্ভের পানিতে যে পরিমাণ পটাসিয়াম পাওয়া যায় তার অধিকাংশ উদ্ভিদ তার প্রয়োজনের তাগিদে শোষণ করে নেয়। কিন্তু Na+ আয়ন সমুদ্রের পানিতে চলে যায়। সমুদ্রের পানি, লবণ হ্রদ এবং লবণের খনিতে Na ও Mg কে যৌগ হিসেবে পাওয়া যায় ।
S ব্লক মৌলের বৈশিষ্ট্যপূর্ণ ধর্ম
ক্ষার ধাতুর বৈশিষ্ট্য :
(১) তড়িৎ ধনাত্মক ধর্ম (Electropositive character) : ক্ষার ধাতুগুলোর যোজ্যতা স্তরে ইলেকট্রন বিন্যাস
ns’। এখানে n = 2, 3, 4. ইত্যাদি।
এরূপ ইলেকট্রন গঠন কাঠামোর জন্য ক্ষার ধাতুগুলোর আয়নিকরণ বিভবের মান খুব কম। এরা একটি মাত্র ইলেকট্রনকে ত্যাগ করে ধনাত্মক আয়নে পরিণত হওয়ার প্রবণতা দেখা যায়। এ কারণে ক্ষার ধাতুগুলো প্রত্যেকেই তীব্র তড়িৎ ধনাত্মক মৌল । গ্রুপ বরাবর উপর থেকে যত নিচের দিকে যাওয়া যায় তড়িৎ ধনাত্মকতা ধর্ম ততই বাড়তে থাকে। গ্রুপ I এর নিচের দিকের ক্ষার ধাতুগুলোর ইলেকট্রন ত্যাগের প্রবণতা এত বেশি যে আলোর উপস্থিতিতেই এরা ইলেকট্রন ত্যাগ করে থাকে। এ কারণে K ও Cs ধাতুকে ফটোইলেকট্রিক সেল তৈরিতে ব্যবহার করা হয়।
(২) গলনাঙ্ক ও স্ফুটনাঙ্ক (Melting points and boiling points) : ক্ষার ধাতুগুলোর গলনাঙ্ক ও স্ফুটনাঙ্কের মান অপেক্ষাকৃত নিম্ন। গ্রুপ বরাবর উপর থেকে যত নিচের দিকে যাওয়া যায় ধাতুগুলোর গলনাঙ্ক ও স্ফুটনাঙ্কের মান তত কমতে থাকে । গলনাঙ্ক ও স্ফুটনাঙ্কের মানের হ্রাসের কারণ ধাতুগুলোর কেলাস ল্যাটিসের বন্ধন দুর্বল হওয়ায় এরা নরম প্রকৃতির হয়। এ ধাতুগুলোর প্রতিটি পরমাণুর সর্ববহিঃস্থ কক্ষে একটি মাত্র ইলেকট্রন থাকার কারণে এদের পারমাণবিক ব্যাসার্ধ যথেষ্ট বড় হয় এবং পরমাণুর আকারও বড় হয়। এর ফলে পরমাণুর মধ্যে বন্ধন শক্তি দুর্বল প্রকৃতির হয়।
ধাতুর পরমাণুর আকার বৃদ্ধির সাথে সাথে বন্ধনে অংশগ্রহণ করেনি এরূপ ইলেকট্রনের সংখ্যার বৃদ্ধি ঘটে। এ কারণে ঐ ইলেকট্রনগুলো দ্বারা পরমাণুর মধ্যে পারস্পরিক বিকর্ষণ বলও বৃদ্ধি পায়। ফলে গলনাঙ্ক ও স্ফুটনাঙ্ক মানের হ্রাস ঘটে। গ্রুপের উপর থেকে নিচের দিকে যত যাওয়া যায় পারস্পরিক বিকর্ষণ বলের মানের তত বৃদ্ধি ঘটে এবং গলনাঙ্ক ও স্ফুটনাঙ্ক মানের হ্রাস ঘটে। এ কারণে ক্ষার ধাতুর ১ম মৌল Li এর গলনাঙ্ক 186°C হলেও Cs এর গলনাঙ্ক মাত্র 28.5°C।
(৩) আয়নিকরণ বিভব (Ionisation potential) : ক্ষার ধাতুগুলোর সর্ববহিঃস্থ কক্ষে s অরবিটালে একটি মাত্র ইলেকট্রন বর্তমান থাকে । অর্থাৎ এদের যোজ্যতা স্তরে ইলেকট্রন বিন্যাস ns’। এখানে, n = 2, 3, 4.. ইত্যাদি।
ক্ষার ধাতুগুলোর পরমাণুর আকার যথেষ্ট বড় হওয়ার কারণে সর্ববহিঃস্থ শক্তিস্তরে ইলেকট্রনের প্রতি নিউক্লিয়াসের আকর্ষণ বল কমে যায়। ফলে সর্ববহিঃস্থ কক্ষের ns’ ইলেকট্রনকে অপসারিত করতে কম শক্তি প্রয়োজন হয়। গ্রুপ বরাবর উপর থেকে নিচের দিকে যত যাওয়া যায় আয়নিকরণ বিভবের মান তত কমতে থাকে। কারণ নতুন শক্তিস্তর যুক্ত হওয়ার কারণে সর্ববহিঃস্থ কক্ষের s ইলেকট্রন নিউক্লিয়াস থেকে দূরে সরে যায়। এর ফলে সর্ববহিঃস্থ কক্ষের ইলেকট্রনের প্রতি নিউক্লিয়াসের আকর্ষণ কমে যায়। কম শক্তি ব্যয় করেই ইলেকট্রনকে অপসারণ করা সম্ভব হয়।
ক্ষার ধাতুগুলোর ১ম আয়নিকরণ বিভবের মান নিম্ন হলেও ২য় আয়নিকরণ বিভবের মান অতি উচ্চ। কারণ
(i) M* আয়নের সুস্থিত ইলেকট্রন বিন্যাস।
(ii) M” আয়নের অপেক্ষাকৃত ক্ষুদ্র আকার ।
(iii) নিউক্লিয়াসের কার্যকরী ধনাত্মক চার্জের বৃদ্ধি, ক্ষার ধাতুর ২য় আয়নিকরণ বিভবের মানকে অতি উচ্চ করে তোলে।
(৪) পারমাণবিক ব্যাসার্ধ (Atomic radious ) : ক্ষার ধাতুগুলো পারমাণবিক ব্যাসার্ধ পর্যায় তালিকায় অন্যান্য গ্রুপের মৌলের পারমাণবিক ব্যাসার্ধের তুলনায় যথেষ্ট বড়। পারমাণবিক সংখ্যা বৃদ্ধির সাথে সাথে গ্রুপ I এর মৌলগুলোর ক্ষেত্রে নতুন নতুন শক্তিস্তরের সৃষ্টি হয়। যোজ্যতাস্তরের ভিতরের স্তরগুলোর সংখ্যা বৃদ্ধি পাওয়ায় ভিতরের স্তরগুলো সিন্ডিং করার ক্ষমতা সামগ্রিকভাবে বেড়ে যায় । এ কারণে গ্রুপ বরাবর উপর থেকে নিচের দিকে পারমাণবিক ব্যাসার্ধের বৃদ্ধি ঘটে।
মনে রাখবেন— গ্রুপ I এর মৌল ক্ষার ধাতুগুলো সর্ববহিঃস্থ শক্তিস্তরে একটিমাত্র ইলেকট্রন বর্তমান থাকে। যোজ্যতাস্তরের পাশাপাশি নিম্নতর স্তরের s ও p অরবিটাল ইলেকট্রন দ্বারা অষ্টক পূর্ণতা থাকে। অবশ্য Li এর ক্ষেত্রে He এর মতো দুটি ইলেকট্রন বর্তমান থাকে । 6 ক্ষার ধাতুগুলোর যোজ্যতা স্তরের পাশাপাশি নিম্নতর শক্তিস্তরের ns np’ ইলেকট্রনীয় গঠন কাঠামো বিদ্যমান থাকায় তীব্র সিন্ডিং প্রভাব দ্বারা ক্ষার ধাতুর যোজ্যতা স্তরের একমাত্র ইলেকট্রনকে তার নিউক্লিয়াসের আকর্ষণ বল থেকে আড়াল করে রাখে।
ফলে ক্ষার ধাতুর যোজ্যতা ইলেকট্রনটি তার পরমাণু নিউক্লিয়াস থেকে অপেক্ষাকৃত দূরে অবস্থান করতে পারে। যোজ্যতাস্তরের ইলেকট্রনটি নিউক্লিয়াসের সাথে অনেকটাই হালকাভাবে যুক্ত থাকে। ক্ষার ধাতুর পূর্ববর্তী গ্রুপ 18তম গ্রুপের মৌল নিষ্ক্রিয় গ্যাসগুলোর ক্ষেত্রে ইলেকট্রন দ্বারা একটি শক্তিস্তর অষ্টক অপূর্ণ হওয়ার পর ক্ষার ধাতু মৌল I গ্রুপের মৌলের শেষ ইলেকট্রনটি তার পরবর্তী এবং অপেক্ষাকৃত বড় আকারের নতুন শক্তিস্তরে প্রবেশ করে। ফলে মৌলের পারমাণবিক ব্যাসার্ধ তথা পরমাণুগুলোর আয়তনের বৃদ্ধি ঘটে। এ কারণে গ্রুপ I এর মৌলগুলোর পারমাণবিক ব্যাসার্ধ ও আয়তন পর্যায় সারণির অন্যান্য গ্রুপের মৌলের পারমাণবিক ব্যাসার্ধ ও আয়তনের তুলনায় বড় হয় ।
৫) ধাতব ধৰ্ম (Metallic Character) : H ব্যতীত I গ্রুপের মৌলসমূহ প্রকৃত অর্থেই আদর্শ ধাতু। এ ধাতুগুলো ঘাতসহ, নমনীয়, তাপ ও বিদ্যুৎ সুপরিবাহী। এদের ছুরি বা চাকু দিয়ে সহজেই কাটা যায়। অর্থাৎ এরা নরম প্রকৃতির। গ্রুপের উপর থেকে যত নিচের দিকে যাওয়া যায় মৌলের ধাতব প্রকৃতি তত বেড়ে যায়। কারণ গ্রুপ বরাবর উপর থেকে নিচের দিকে যত আসা যায় মৌলগুলোর আকার তত বেড়ে যায় ও আয়নিকরণ বিভবের মান তত কমে যায় এবং ধাতব ধর্ম বেড়ে যায়।
(৬) শিখা পরীক্ষার বর্ণ : ক্ষার ধাতু এবং এদের লবণগুলো বুনসেন বার্নারের শিখায় বিভিন্ন বর্ণ প্রদর্শন করে থাকে । এই বর্ণ থেকে ক্ষার ধাতু বা তার আয়ন সম্পর্কে ধারণা লাভ করা যায় ।

ক্ষার ধাতু ও ধাতুর লবণকে শিখায় ধরলে ধাতুর সর্ববহিঃস্থ কক্ষে ইলেকট্রনটি শক্তি শোষণ করে সক্রিয় হয় এবং উচ্চতর শক্তিস্তরে ইলেকট্রনের ধাপান্তর ঘটে। এ উত্তেজিত ইলেকট্রনগুলো যখন উচ্চতর শক্তিস্তর থেকে শক্তিকে বিকিরণ করে পুনরায় পূর্বের নিম্নশক্তিস্তরে নেমে আসে। বিকিরিত শক্তি দৃশ্যমান আলোরূপে দেখা যায় ।
যে পরিমাণ শক্তিকে শোষণ করে Li পরমাণুর 2s অরবিটালের ইলেকট্রনটি যে উচ্চ শক্তিস্তরে যেতে পারে, Na এর 3s অরবিটালে ইলেকট্রনটি তার থেকে আরও বেশি উচ্চ শক্তিস্তরে যেতে পারে। এ উত্তেজিত ইলেকট্রনগুলো পুনরায় যখন পূর্বের অবস্থানে ফিরে আসে তখন ওদের দ্বারা বিভিন্ন পরিমাণ শক্তি বিকিরিত হয়। বিকিরিত শক্তির পরিমাণ Li এর ক্ষেত্রে সবচেয়ে কম হয়। বিকিরিত শক্তির বৃদ্ধির ক্রম, Li< Na < K < Rb < Cs । প্রতিটি ক্ষেত্রে যে পরিমাণ শক্তি বিকিরিত হয় তার কম্পাঙ্ক ও তরঙ্গদৈর্ঘ্য অনুসারে শিখার বর্ণ নির্ধারিত হয়। Li থেকে বিকিরিত শক্তি কম্পাঙ্ক সবচেয়ে কম হয় বলে Li গাঢ় লাল বর্ণের শিখা সৃষ্টি হয়। Cs থেকে বিকিরিত শক্তি কম্পাঙ্ক সবচেয়ে বেশি হয় বলে Cs বেগুনি বর্ণের শিখা সৃষ্টি করে ।
(৭) প্যারাচুম্বকত্ব ও ডায়াচুম্বকত্ব ধর্ম : ক্ষার ধাতুগুলো প্রত্যেকেরই যোজ্যতা স্তরে s অরবিটালে একটিমাত্র ইলেকট্রন বর্তমান। অর্থাৎ ns’ ইলেকট্রনীয় গঠন কাঠামো প্রাপ্ত থাকে। এখানে n = 2, 3, 4……….. ইত্যাদি। যোজ্যতা স্তরে s অরবিটালে ইলেকট্রনটি অযুগ্মভাবে অবস্থান করায় ক্ষার ধাতু প্যারাচুম্বকত্ব ধর্ম সম্পন্ন হয়। ক্ষার ধাতু তার যোজ্যতাস্তরে ns’ ইলেকট্রনটিকে দান করে M+ আয়নে পরিণত হয়। M’ আয়নটি ক্ষার ধাতুটি যে পর্যায়ে অবস্থান করে ঠিক তার পূর্ববর্তী পর্যায় নিষ্ক্রিয় মৌলের ইলেকট্রনীয় গঠনকাঠামো প্রাপ্ত হয়। M’ আয়নের পারমাণবিক অরবিটালের কোনো অযুগ্ম ইলেকট্রন না থাকায় এটি ডায়াচুম্বকত্ব ধর্ম প্রদর্শন করে। অর্থাৎ চুম্বক দ্বারা আকৃষ্ট হয় না।
(৮) নরম ধাতু : ক্ষার ধাতুগুলো নরম প্রকৃতির। সহজেই ছুরি বা চাকু দ্বারা কাটা যায়। ক্ষার ধাতুগুলোর পারমাণবিক আয়তন বৃহৎ হওয়ার জন্য এদের মধ্যে ধাতব বন্ধনশক্তি খুবই দুর্বল প্রকৃতির হয়। ফলে ক্ষার ধাতু নরম প্রকৃতির হয়। গ্রুপের উপর থেকে যত নিচে যাওয়া যায় পারমাণবিক আকারের তত বৃদ্ধি ঘটে এবং ধাতব বন্ধন দুর্বল হতে থাকে। ধাতুর নরম প্রকৃতি বৃদ্ধি পেতে থাকে। Li থেকে Na, Na থেকে K এবং K থেকে Rb বেশি নরম প্রকৃতির হয়।
(৯) বিজারণ ধর্ম (Reducing Property) : ক্ষার ধাতুর মৌলগুলোর ক্ষেত্রে গ্রুপ বরাবর উপর থেকে যত নিচের দিকে যাওয়া যায় পারমাণবিক আকার তত বাড়তে থাকে। ফলে বিজারণ ক্ষমতাও বাড়তে থাকে। গ্রুপ বরাবর উপর থেকে নিচের দিকে আয়নিকরণ বিভবের মান কমতে থাকে। এ কারণে Cs হলো তীব্র বিজারক এবং Li হলো সবচেয়ে দুর্বল বিজারক ।
মৃৎক্ষার ধাতুর বৈশিষ্ট্যসমূহ :
ক্ষার ধাতুগুলোর ন্যায় মৃৎক্ষার ধাতুগুলোও যথেষ্ট সক্রিয়। এ কারণে এদেরকে মুক্ত অবস্থায় পাওয়া যায় না। বিভিন্ন যৌগ হিসাবে বিশেষ করে সিলিকেট, কার্বনেট, সালফেট ও ফসফেট হিসাবে প্রকৃতিতে এদের পাওয়া যায়। প্রকৃতিতে পরিমাণ হিসাবে Ca এর অবস্থান পঞ্চম ও Mg এর অবস্থান ষষ্ঠ। মৃৎক্ষার ধাতুগুলো সাদা ধূসর বর্ণের হলেও বায়ুর সংস্পর্শে এসে এদের উজ্জ্বলতা নষ্ট হয়। এরা ঘাতসহ, নমনীয় এবং এদের ধাতব দ্যুতি আছে । ক্ষার ধাতু অপেক্ষাও মৃৎক্ষার ধাতুগুলো দৃঢ় প্রকৃতির ও অপেক্ষাকৃত শক্ত ।
(i) বিজারণ ধর্ম (Reducing property) : ক্ষার ধাতুর তুলনায় মৃৎক্ষার ধাতুগুলো অপেক্ষাকৃত দুর্বল বিজারক। গ্রুপ বরাবর উপর থেকে যত নিচের দিকে যাওয়া যায় এদের বিজারণ ধর্ম তত বৃদ্ধি পায়। মৃৎক্ষার ধাতুগুলো যোজ্যতা স্তরে s অরবিটালের 2টি ইলেকট্রনকে দান করে ধনাত্মক দ্বিযোজী আয়নে পরিণত হয় । M → M2+ + 2e
(ii) পারমাণবিক ও আয়নিক ব্যাসার্ধ : মৃৎক্ষার ধাতুগুলো পারমাণবিক ও আয়নিক ব্যাসার্ধ ক্ষার ধাতুর তুলনায় অপেক্ষাকৃত ছোট। মৃৎক্ষার ধাতুগুলোর ক্ষেত্রে নিউক্লিয়াসের ধনাত্মক চার্জের পরিমাণ বেশি হওয়ায় ইলেকট্রনগুলো নিউক্লিয়াস দ্বারা অধিকমাত্রায় আকর্ষিত হয়। পারমাণবিক আয়তনের হ্রাস ঘটে। আয়নিক ব্যাসার্ধের ক্ষেত্রে নিউক্লিয়াসের ধনাত্মক চার্জের পরিমাণ 2 একক বৃদ্ধি পাওয়ায় এ মানের আরও অধিক হ্রাস ঘটে। এ মান ক্ষার ধাতুর তুলনায় ছোট।
(iii) আয়নিকরণ বিভব : ক্ষার ধাতুর তুলনায় মৃৎক্ষার ধাতুগুলোর আয়নিকরণ বিভবের মান অপেক্ষাকৃত বেশি। এদের অপেক্ষাকৃত ছোট আকার ও কম পারমাণবিক ব্যাসার্ধের কারণে আয়নিকরণ বিভবের মানের বৃদ্ধি ঘটে। মৃৎক্ষার ধাতুর দ্বিতীয় আয়নিকরণ বিভবের মান ক্ষার ধাতুর তুলনায় বেশী।
উদাহরণস্বরূপ : ক্ষারধাতু Na এর ১ম আয়নিকরণ বিভবের মান 495.8 kJ.mol’ হলেও মৃৎক্ষার ধাতু Mg ১ম আয়নিকরণ বিভবের মান 737-7 kJ mol’। তবে মৃৎক্ষার ধাতুর ২য় আয়নিকরণ বিভবের মান ক্ষার ধাতুর তুলনায় যথেষ্ট নিম্ন। Mg ২য় আয়নিকরণ বিভবের মান 1450kJ.mol” হলেও Na ২য় আয়নিকরণ বিভবের মান 4562 kJ. molt ।
(iv) শিখা পরীক্ষায় বর্ণ : মৃৎক্ষার ধাতুগুলোর মধ্যে বেরিলিয়াম, ম্যাগনেসিয়াম ব্যতীত অন্যান্য ধাতুগুলো এবং তাদের উদ্বায়ী লবণ বিশেষ করে ধাতব ক্লোরাইড শিখা পরীক্ষায় বিভিন্ন বর্ণের শিখা প্রদর্শন করে থাকে ।
মৃৎক্ষার ধাতু বা তাদের উদ্বায়ী ক্লোরাইড লবণকে বুনসেন বার্নারের শিখায় উত্তপ্ত করলে যোজ্যতা কক্ষের ইলেকট্রন দুটি শক্তি শোষণ করে উত্তেজিত হয় এবং উচ্চতর শক্তিস্তরে ধাপান্তরিত হয়। এ উত্তেজিত অবস্থা ও ইলেকট্রনের ধাপান্তর খুবই ক্ষণস্থায়ী। তাৎক্ষণিক সময়ের মধ্যে উত্তেজিত ইলেকট্রন পুনরায় পূর্বের নিম্নতর শক্তিস্তরে চলে আসে। এ অবস্থায় ইলেকট্রন দ্বারা শোষিত শক্তি বিকিরিত হয়। এই বিকিরিত ফোটনের শক্তি দৃশ্যমান তরঙ্গদৈর্ঘ্যের সীমার মধ্যে পড়ে।
বেরিলিয়াম ও ম্যাগনেসিয়ামের পরমাণুর আকার অপেক্ষাকৃত ছোট হওয়ায় তাদের যোজ্যতাস্তরের ইলেকট্রন দুটি নিউক্লিয়াস দ্বারা তীব্রভাবে আকর্ষিত হয়। এ দুটি মৌলের আয়নিকরণ বিভবের মানও খুব উচ্চ। পরমাণু দুটির যোজ্যতাস্তরের 2s ও 3s অরবিটালের ইলেকট্রন দুটিকে উত্তেজিত করে উচ্চশক্তিস্তরে নিয়ে যাওয়ার জন্য প্রচুর পরিমাণ শক্তির প্রয়োজন পড়ে। বুনসেন বার্নারের শিখা থেকে এ ধরনের শক্তি পাওয়া সম্ভব নয় বলে তাদের ইলেকট্রনগুলো উত্তেজিত করে উচ্চতর শক্তিস্তরে নিয়ে যাওয়া সম্ভব হয় না।
p ব্লক মৌল :
p ব্লক মৌলগুলোর বৈশিষ্ট্য (Characteristics of p-block elements) :
p ব্লক মৌলগুলোর বেশকিছু বৈশিষ্ট্যপূর্ণ ধর্ম পরিলক্ষিত হয়। যেমন—
(i) পারমাণবিক ও আয়নিক ব্যাসার্ধ (Atomic and ionic radius ) : p ব্লক মৌলগুলোর পারমাণবিক ব্যাসার্ধ পর্যায় বরাবর বাম থেকে ডানের দিকে কমতে থাকে কিন্তু 18তম গ্রুপে গিয়ে এ মানের বৃদ্ধি ঘটে। গ্রুপ বরাবর যেকোনো গ্রুপের ক্ষেত্রে উপর থেকে নিচের দিকে পারমাণবিক ব্যাসার্ধের মানের বৃদ্ধি ঘটে। আয়নিক ব্যাসার্ধের মানের ক্ষেত্রেও এ রীতি প্রযোজ্য ।
(ii) আয়নিকরণ বিভব (Ionisation potential) : p ব্লক মৌলের আয়নিকরণ বিভবের ক্ষেত্রে পর্যায় বরাবর বাম থেকে ডানের দিকে অগ্রসর হলে সাধারণত বৃদ্ধি পেতে থাকে। 15তম গ্রুপ অপেক্ষা 16তম গ্রুপের মৌলের আয়নিকরণ বিভবের মান নিম্ন । গ্রুপ বরাবর উপর থেকে নিচের দিকে গেলে আয়নিকরণ বিভবের মানের হ্রাস ঘটে। 18 তম গ্রুপের মৌল নিষ্ক্রিয় মৌল। এদের আয়নিকরণ বিভবের মান অতি উচ্চ।
(iii) জারণ ও বিজারণ বিভব (Oxidising and reducing properties) : p ব্লক মৌলের মধ্যে বেশকিছু মৌল আছে যারা উত্তম বিজারক। যেমন— Al, Sn Pb প্রভৃতি। 17তম গ্রুপের মৌলসমূহ তীব্র জারক। গ্রুপ বরাবর উপর থেকে নিচের দিকে যত যাওয়া যায় জারণ ধর্ম তত কমতে থাকে। পর্যায় বরাবর বাম থেকে ডানের দিকে অগ্রসর হতে থাকলে জারণ ধর্ম বাড়তে থাকে।
(iv) জারণ অবস্থা (Oxidation state) : p ব্লক মৌল বিশেষ করে 13তম গ্রুপের মৌলের ক্ষেত্রে, সাধারণভাবে তাদের জারণ অবস্থা +3 প্রদর্শন করে থাকে। তবে গ্রুপ বরাবর উপর থেকে যত নিচের দিকে যাওয়া যায় নিষ্ক্রিয় জোড় ইলেকট্রনের প্রভাবে জারণ অবস্থার মান কমতে থাকে। উদাহরণস্বরূপ গ্যালিয়াম (Ga), ইন্ডিয়াম (In), থ্যালিয়াম (TI) +3 ও +1 উভয়কেই প্রদর্শন করে থাকে ।
প্রকৃতপক্ষে +1 জারণ অবস্থার স্থায়িত্ব গ্রুপের নিচের দিকে বাড়তে থাকে। এ কারণে গ্রুপের উপর থেকে নিচের দিকে নামতে থাকলে ns2 ইলেকট্রনের বন্ধন গঠনে অংশগ্রহণ করার প্রবণতা কমতে থাকে। এরূপ একজোড়া ইলেকট্রন যেটি বন্ধন গঠনে অংশগ্রহণ করে না তাদেরকে নিষ্ক্রিয় জোড় এবং বন্ধন গঠনে একজোড়া ইলেকট্রনের অংশগ্রহণ না করার প্রবণতাকে নিষ্ক্রিয় জোড় প্রভাব বলে ।
(v) তড়িৎ ধনাত্মকতা (Electropositivity) : s ব্লকের মৌল গ্রুপ I ও II এর ন্যায় p ব্লকের 13 গ্রুপের মৌলগুলোও তড়িৎ ধনাত্মক মৌল। তবে এদের তড়িৎ ধনাত্মকতা গ্রুপের I ও II এর মৌল অপেক্ষা নিম্ন। 13 তম গ্রুপের মৌলের অপেক্ষাকৃত ছোট পারমাণবিক ব্যাসার্ধ ও উচ্চ আয়নিকরণ বিভব এর জন্য দায়ী। 13 তম গ্রুপের মৌলের উপরের দিক থেকে নিচের দিকে অগ্রসর হলে B থেকে Al এর দিকে তড়িৎ ধনাত্মকতা মানের বৃদ্ধি এবং Al থেকে নিচের দিকে তড়িৎ ধনাত্মকতা মানের হ্রাস ঘটে। B অপেক্ষা Al এর পারমাণবিক আকারের বৃদ্ধি ও আয়নিকরণ বিভবের মানের হ্রাস এজন্য দায়ী।
Al এর নিচের মৌল Ga, In ও TI এর ক্ষেত্রে তড়িৎ ধনাত্মকতার মানের হ্রাসের কারণ হলো Ga ও In এর d অরবিটাল এবং TI এর d ও f অরবিটাল এর অকার্যকর আবরণী ক্ষমতা (Screening effect) এর কারণে নিউক্লিয়াসকে ইলেকট্রন দ্বারা ঠিকমতো আড়াল করে রাখতে পারে না। এ কারণে যোজ্যতা স্তরে ইলেকট্রনের প্রতি নিউক্লিয়াসের আকর্ষণ তীব্রতর হয়। ফলে পরমাণু ইলেকট্রনকে সহজে দান করতে পারে না। Al থেকে নিচের দিকে অগ্রসর হলে মৌলের তড়িৎ ধনাত্মকতা তথা ধাতব চরিত্রের হ্রাস ঘটে।
p ব্লকের 14তম গ্রুপের মৌলের তড়িৎ ধনাত্মকতার মান 13তম গ্রুপ অপেক্ষা কম। গ্রুপ বরাবর উপর হতে নিচের দিকে তড়িৎ ধনাত্মকতা মানের বৃদ্ধি ঘটে। গ্রুপ বরাবর উপর হতে নিচের দিকে পারমাণবিক ব্যাসার্ধের বৃদ্ধিজনিত কারণে যোজ্যতাস্তরের ইলেকট্রনের প্রতি নিউক্লিয়াসের আকর্ষণ বলের প্রভাব কমে যায়। এ কারণে আয়নিকরণ বিভবের মানও কমে যায় এবং তড়িৎ ধনাত্মকতা বেড়ে যায়। ১৪তম গ্রুপের মৌল কার্বন (C) অধাতু, সিলিকন উপধাতু, জারমেনিয়াম (Ge) উপধাতু, টিন (Sn) ধাতু, লেড (Pb) ধাতু ।
p ব্লক মৌলের 15 তম গ্রুপের মৌল N, P, As Sb, Bi এর মধ্যে N, P অধাতব মৌল। As ও Sb উপধাতু Bi দুর্বল ধাতু। এদের তড়িৎ ধনাত্মকতার মান খুবই নিম্ন। p ব্লকের মৌল 16 তম গ্রুপের মৌল O ও S অধাতব মৌল এবং এদের তড়িৎ ঋণাত্মকতা ধর্ম বর্তমান। Se ও Te উপধাতু। Po দুর্বল ধাতু । p ব্লক মৌলের 17তম গ্রুপের মৌল F, Cl, Br, I, At প্রত্যেকেই অধাতব প্রকৃতির মৌল। এরা অতিশয় তড়িৎ ঋণাত্মক মৌল। এদের তড়িৎ ধনাত্মকতা ধর্ম খুবই নিম্ন।
18তম গ্রুপের মৌলসমূহ নিষ্ক্রিয় মৌল। (vi) তড়িৎ ঋণাত্মকতা (Electronegativity) : p ব্লক মৌলের ক্ষেত্রে পর্যায় বরাবর বাম থেকে ডানের দিকে অগ্রসর হলে তড়িৎ ঋণাত্মকতা বাড়তে থাকে। গ্রুপ বরাবর উপর থেকে নিচের দিকে গেলে তড়িৎ ঋণাত্মকতা কমতে থাকে। সাধারণভাবে ধাতব মৌল অপেক্ষা অধাতব মৌলের মধ্যে তড়িৎ ঋণাত্মকতা ধর্মের বৃদ্ধি ঘটে। p ব্লক মৌলের তড়িৎ ঋণাত্মকতা মানের সারণি-
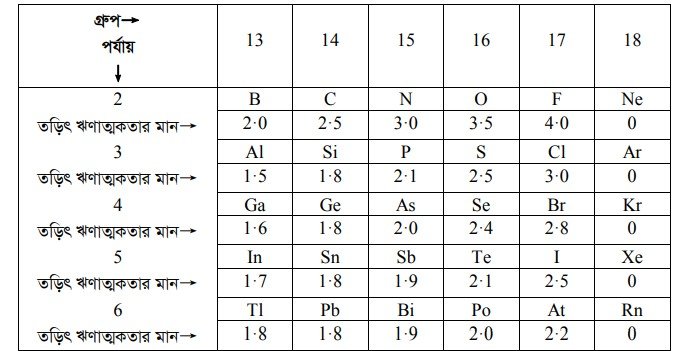
p ব্লক মৌলের রাসায়নিক ধর্ম
পর্যায় তালিকায় গ্রুপ 13 থেকে গ্রুপ 18 পর্যন্ত মৌলসমূহ p ব্লক মৌল। এদের রাসায়নিক ধর্মের ক্ষেত্রে বৈচিত্র্যপূর্ণ বৈশিষ্ট্য পরিলক্ষিত হয়। ভিন্ন ভিন্ন ভাবে এক এক গ্রুপের মৌলের রাসায়নিক ধর্ম এক এক রকম। তবে একই গ্রুপের মৌলের ধর্মের ক্ষেত্রে যথেষ্ট সাদৃশ্য দেখা যায় ।
13তম গ্রুপের মৌলের রাসায়নিক ধর্ম (Chemical Properties of Group – 13 Elements) :
B ব্যতীত এ গ্রুপের অন্যান্য মৌলগুলো ধাতব প্রকৃতির। তাই এরা তড়িৎ ধনাত্মক মৌল। 13তম গ্রুপের উপর থেকে যত নিচের দিকে যাওয়া যায় মৌলের তড়িৎ ধনাত্মক ধর্ম তত বাড়তে থাকে। মৌলগুলো যৌগ গঠনের ক্ষেত্রে বেশির ভাগ ক্ষেত্রেই +3 জারণ অবস্থা প্রদর্শন করলেও + 1 জারণ অবস্থাও প্রদর্শন করে থাকে ।
13তম গ্রুপের মৌল B এর ক্ষুদ্র পারমাণবিক আকার, ক্ষুদ্র আয়নিক ব্যাসার্ধ, উচ্চ আয়নিকরণ বিভব ও যোজ্যতা স্তরে d অরবিটালের অনুপস্থিতির কারণে B সমযোজী প্রকৃতির যৌগ গঠন করে থাকে। এমনকি অতিশয় তড়িৎ ঋণাত্মক মৌল X এর সাথে যুক্ত হয়ে (BX3) বোরন ট্রাই হ্যালাইড এর ক্ষেত্রে B সমযোজী বন্ধন সৃষ্টি করে থাকে ।

গ্রুপ-13 নিচের দিকের মৌল Ga, Tn ও TI মৌল তিনটি +3 জারণ অবস্থা অপেক্ষা +1 জারণ অবস্থা অধিক স্থায়ী বিধায় এরা মনো হ্যালাইড যৌগ গঠন করে। হ্যালাইড যৌগগুলোর মধ্যে ফ্লোরাইড যৌগগুলোর বন্ধন প্রকৃতি আয়নিক ও উচ্চ গলনাঙ্কবিশিষ্ট । ব্যতিক্রম বোরন। ক্লোরাইড, ফ্লোরাইড, আয়োডাইড যৌগ সমযোজী প্রকৃতির ও নিম্ন স্ফুটনাঙ্কবিশিষ্ট। বোরন হ্যালাইডগুলো সমযোজী প্রকৃতির বলে এরা তড়িৎ অপরিবাহী, পানিতে অদ্রবণীয় এবং জৈব দ্রাবকে দ্রবণীয় ।
14তম গ্রুপের মৌলের রাসায়নিক ধর্ম :
(১) অ-িজেনের সাথে : 14তম গ্রুপের মৌল অক্সিজেনের সাথে বিক্রিয়া করে দুই ধরনের অক্সাইড যৌগ গঠন করে।

(২) হাইড্রোজেনের সাথে : লেড (Pb) ভিন্ন 14তম গ্রুপের মৌলগুলো হাইড্রোজেনের সাথে বিক্রিয়া করে MH, যৌগ গঠন করে থাকে। হাইড্রাইড যৌগের ক্ষেত্রে সমযোজী বন্ধনের মাধ্যমে MH, অণু গঠিত হয় ।
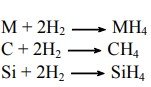
৩) হ্যালোজেনের সাথে : 14তম গ্রুপের মৌলগুলো হ্যালোজেনের সাথে বিক্রিয়া করে MX, ও MX, আণবিক সংকেতবিশিষ্ট হ্যালাইড যৌগ গঠন করে।
M + X2 MX2 ; M + 2X2 MX4
গ্রুপ 15 মৌলসমূহ
নাইট্রোজেন (N), ফসফরাস (P), আর্সেনিক (As), অ্যান্টিমনি (Sb), বিসমাথ (Bi) মৌলগুলো পর্যায় তালিকায় 15 তম গ্রুপের মৌল। পর্যায় সারণির 15তম গ্রুপের মৌলগুলোকে নাইকোজেনস ( Pnicogens) বলা হয়। গ্রিক ভাষায় Pnicogens শব্দের অর্থ শ্বাসরোধক। 15 তম গ্রুপের মৌলগুলো কোনটি শ্বাসকার্যে সহায়তা করে না ।
১৫ তম গ্রুপের মৌলগুলোর সাধারণ ধৰ্ম :
(i) গলনাঙ্ক ও স্ফুটনাঙ্ক : 15তম গ্রুপের মৌলগুলোর মধ্যে একমাত্র N গ্যাসীয়। এ গ্রুপের মৌলের ক্ষেত্রে গ্রুপ বরাবর উপর থেকে নিচের দিকে মৌলগুলো গলনাঙ্ক ও স্ফুটনাঙ্ক বৃদ্ধি পায়। তবে বিসমাথ (Bi) এর গলনাঙ্ক তুলনামূলকভাবে বেশ কম।
(ii) পারমাণবিক ব্যাসার্ধ : 15তম গ্রুপের মৌলগুলোর পারমাণবিক ব্যাসার্ধ অপেক্ষাকৃত ছোট। গ্রুপ 15 এর মৌলগুলো নিউক্লিয়াসে চার্জের পরিমাণ বেশি হওয়ায় যোজ্যতাস্তরের ইলেকট্রনগুলোকে তীব্রভাবে নিউক্লিয়াস আকর্ষণ করে। ফলে পারমাণবিক ব্যাসার্ধের মানের হ্রাস ঘটে। গ্রুপ বরাবর উপর থেকে যত নিচের দিকে যাওয়া যায় পারমাণবিক ব্যাসার্ধের মানের তত বৃদ্ধি ঘটে। কিন্তু N থেকে P পরমাণুতে পারমাণবিক ব্যাসার্ধ যে হারে বৃদ্ধি পায় বাকিদের ক্ষেত্রে ততটা বৃদ্ধি পায় না। কারণ P এর পরবর্তী মৌলগুলোতে d ও f উপকক্ষের ইলেকট্রনে দুর্বল আবরণী ক্ষমতার কারণে এ ধরনের ব্যতিক্রমের সৃষ্টি হয়।
(iii) আয়নিকরণ বিভব : 15তম গ্রুপের মৌলগুলোর আয়নিকরণ বিভবের মান 14তম গ্রুপের মৌলগুলোর আয়নিকরণ বিভবের মানের তুলনায় অনেক বেশি। 15তম গ্রুপের মৌলগুলোর নিউক্লিয়াসে চার্জের পরমাণ বেশি হওয়ায় যোজ্যতাস্তরে ইলেকট্রনের প্রতি আকর্ষণ বলের প্রভাবও বেশি।
এ কারণে আয়নিকরণ বিভবের মানও বেশি হয়। গ্রুপ বরাবর উপর থেকে নিচের দিকে নামতে থাকলে আয়নিকরণ বিভবের মানের ক্রমশ হ্রাস ঘটে। কারণ গ্রুপ বরাবর নিচের দিকে নামতে থাকলে পরমাণুর পারমাণবিক ব্যাসার্ধের মানের বৃদ্ধি ঘটে। ফলে যোজ্যতাস্তরে ইলেকট্রনের প্রতি নিউক্লিয়াসের আকর্ষণ বল কমে যায়, আয়নিকরণ বিভবের মানও কমে যায়।
(iv) জারণ অবস্থা : 15তম গ্রুপের মৌলসমূহের যোজ্যতাস্তরে ইলেকট্রন বিন্যাস ns np3। অষ্টক পূর্ণতার জন্য আরও অতিরিক্ত তিনটি ইলেকট্রনের প্রয়োজন। এ গ্রুপের মৌলগুলো যখন তিনটি ইলেকট্রনকে গ্রহণ করে M আয়নে পরিণত হয় তখন অনেক শক্তির প্রয়োজন হয়। যা ঐ মৌলের ল্যাটিস শক্তি থেকে সংগ্রহ করার প্রয়োজন হয়। শুধু N ও P পরমাণুর আকার ছোট হওয়ায় N2 ও P3 আয়ন সৃষ্টি করা সম্ভব হয়। বাকি মৌলগুলোর পক্ষে M আয়নে পরিণত হওয়া সম্ভব নয়।
N আয়নে পরিণত হতে 2130 kJmol’ ও p আয়নে পরিণত হতো 1450 kJ.mol’ শক্তির প্রয়োজন হয়। উচ্চ আয়নিকরণ বিভবের কারণে 15তম গ্রুপের মৌলগুলোর ক্যাটায়ন গঠন করার প্রবণতা অপেক্ষাকৃত কম। তবুও এরা +3 3 +5 জারণ অবস্থা প্রদর্শন করে থাকে। গ্রুপ বরাবর উপর থেকে নিচের দিকে +5 আয়নে পরিণত হওয়ার প্রবণতা অপেক্ষা +3 আয়নে পরিণত হওয়ার প্রবণতা বেড়ে যায়। এ কারণে গ্রুপ বরাবর উপর থেকে নিচের দিকে নামলে মৌলের যৌগের মধ্যে সমযোজী বৈশিষ্ট্য কমে যায় এবং আয়নিক বৈশিষ্ট্য বেড়ে যায়।
মনে রাখবেন : নাইট্রোজেন পরমাণুর ক্ষেত্রে +5 থেকে 3 পর্যন্ত সকল জারণ অবস্থাই প্রদর্শন করা সম্ভব। HNO3 অণুতে +5, N2O4 অণুতে +4, HNO2 অণুতে +3, NO অণুতে +2, N2O অণুতে =1, N2 অণুতে O, NH, OH অণুতে –1 এবং NH3 অণুতে –3 জারণ অবস্থা প্রদর্শন করে ।
16 তম গ্রুপের মৌল :
অক্সিজেন (O), সালফার (S), সেলেনিয়াম (Se), টেলুরিয়াম (Te), পোলোনিয়াম (Po) এর মৌলগুলো পর্যায় সারণির 16 তম গ্রুপের মৌল। এ মৌলগুলোর প্রথম চারটি মৌলকে চ্যালকোজেন মৌল বলে।
১৬ তম গ্রুপের মৌলের সাধারণ ধর্ম :
১. গলনাঙ্ক ও স্ফুটনাঙ্ক : 16তম গ্রুপের মৌলগুলোর ক্ষেত্রে অক্সিজেনের গলনাঙ্ক (–218°C) ও স্ফুটনাঙ্ক (–183°C) এর মান নিম্ন হলেও এ গ্রুপের পরবর্তী মৌল সালফার এর গলনাঙ্ক (112°C) ও স্ফুটনাঙ্ক (446°C) এর মান উচ্চ। এভাবে গ্রুপ বরাবর নিচের দিকে নামতে থাকলে উপর থেকে নিচের দিকে পারমাণবিক আয়তনের বৃদ্ধির সাথে সাথে ভ্যান্ডার ওয়ালস আকর্ষণ বলের মানের বৃদ্ধি ঘটে ।
২. পারমাণবিক ব্যাসার্ধ : 15 তম গ্রুপের তুলনায় 16 তম গ্রুপের মৌলগুলোর পারমাণবিক ব্যাসার্ধের মান নিম্ন। গ্রুপ বরাবর উপর থেকে নিচের দিকে পারমাণবিক সংখ্যা বৃদ্ধির সাথে পারমাণবিক ব্যাসার্ধের বৃদ্ধি ঘটে।
৩. আয়নিকরণ বিভব : 16 তম গ্রুপের মৌলগুলোর আয়নিকরণ বিভবের মান 15 তম গ্রুপের তুলনায় অপেক্ষাকৃত নিম্ন হয় । গ্রুপ বরাবর উপর থেকে নিচের দিকে আয়নিকরণ বিভবের মানের হ্রাস ঘটে। কারণ গ্রুপ বরাবর উপর থেকে নিচের দিকে পারমাণবিক ব্যাসার্ধের বৃদ্ধি এবং ইলেকট্রনের আবরণী ক্ষমতা বৃদ্ধি পাওয়ার কারণে যোজ্যতাস্তরের ইলেকট্রনের সাথে নিউক্লিয়াসের আকর্ষণ শক্তির মানের হ্রাস ঘটে ।
৪. জারণ অবস্থা : 16 তম গ্রুপের মৌলের যোজ্যতাস্তরের ইলেকট্রনীয় গঠন কাঠামো ns2np’। নিষ্ক্রিয় মৌলের ইলেকট্রনীয় গঠন প্রাপ্তির জন্য আর দুটি মাত্র ইলেকট্রনের প্রয়োজন। এ কারণে এ গ্রুপের মৌলের M2 আয়নিক অবস্থা প্রাপ্ত হওয়ার প্রবণতা সর্বাধিক। উপরন্তু পরমাণুগুলোর ইলেকট্রন বিন্যাস ns np অবস্থার কারণে মৌলের পরমাণুগুলো যোজ্যতাস্তরের দুটি ইলেকট্রনকে ব্যবহার করে দুটি সমযোজী বন্ধনের মাধ্যমে নিষ্ক্রিয় মৌলের ইলেকট্রনীয় গঠন কাঠামো প্রাপ্ত হতে পারে ।
16তম গ্রুপের মৌলের মধ্যে অক্সিজেন ভিন্ন সকল মৌলই যৌগের মধ্যে ধনাত্মক ও ঋণাত্মক জারণ অবস্থা প্রদর্শন করে থাকে । ফ্লোরিনের তড়িৎ ঋণাত্মকতার মান 4 আর অক্সিজেনের তড়িৎ ঋণাত্মকতার মান 3-5। অক্সিজেন ফ্লোরিন অপেক্ষা কম তড়িৎ ঋণাত্মক হওয়ায় OF2 যৌগের মধ্যে অক্সিজেন +2 জারন মান প্রদর্শন করে থাকে ।
১৭তম গ্রুপের মৌল :
পর্যায় সারণির 17 তম গ্রুপের অধাতব মৌল F, Cl, Br, I ও At. এদের ভৌত ও রাসায়নিক ধর্মের মধ্যে অনেক সাদৃশ্য থাকায় এদের একই পরিবারভুক্ত বলা হয়। সমুদ্রের পানিতে ফ্লোরিন, ক্লোরিন, ব্রোমিন ও আয়োডিন লবণ পাওয়া যায়। এ কারণে F, Cl, Br, ও I এ মৌলগুলোকে সাধারণভাবে হ্যালোজেন বলে। গ্রিক ভাষার halos শব্দের অর্থ Sea-salt এবং genes অর্থ to produce অর্থাৎ halogens শব্দের অর্থ Sea-salt producers, যা দিয়ে সমুদ্রের লবণ উৎপন্ন করা হয় ।
উচ্চ তড়িৎ ঋণাত্নকতার জন্য হ্যালোজেন মৌলগুলো অতিশয় সক্রিয় হয়। এদেরকে মুক্ত অবস্থায় পাওয়া যায় না। ফ্লোরিনকে পাওয়া যায় (i) ফ্লোরস্পার (CaF2), (ii) ক্রায়োলাইট (Na3AlF6), ক্লোরিনকে পাওয়া যায় (i) সোডিয়াম ক্লোরাইড (NaCl), (ii) রক সল্ট (NaCl), (iii) কার্নাসাইট (KCl.MgCl2.6H2O), ব্রোমিনকে কার্নাসাইটের মধ্যে KBr ও MgBr2 হিসাবে এবং আয়োডিনকে চিলি সল্ট পিটার (NaNO3. NaIO3) হিসাবে পাওয়া যায়। হ্যালোজেনগুলো দ্বিপরমাণুক সমযোজী অণু হিসাবে অবস্থান করে। F2, C] গ্যাসীয়, Br2 তরল এবং I, কঠিন অবস্থায় অবস্থান করে।
১৭তম গ্রুপের মৌলের সাধারণ ধর্ম :
১। গলনাঙ্ক ও স্ফুটনাঙ্ক : 17তম গ্রুপের মৌলগুলোর অণুর আকৃতি বাড়ার সাথে সাথে F2 থেকে I, এর দিকে গলনাঙ্ক ও স্ফুটনাঙ্কের বৃদ্ধি ঘটে। অণুগুলোর আকার বাড়ার সাথে সাথে ভ্যান্ডার ওয়ালস আকর্ষণ বলের মান বেড়ে যায়। ফলে এদের গলনাঙ্ক ও স্ফুটনাঙ্কের মান বেড়ে যায়।
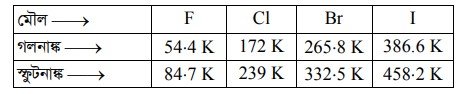
২। পারমাণবিক ব্যাসার্ধ : 16 তম গ্রুপের তুলনায় 17 তম গ্রুপের মৌলের পারমাণবিক ব্যাসার্ধের মান তুলনামূলকভাবে ছোট হয়। গ্রুপ বরাবর উপর থেকে নিচের দিকে ক্রমাগত শক্তিস্তরের সংখ্যা বাড়ার ফলে পারমাণবিক ব্যাসার্ধের মান বেড়ে যায়। পারমাণবিক ব্যাসার্ধের মতো আয়নিক ব্যাসার্ধেও একই ক্রম পরিলক্ষিত হয়।
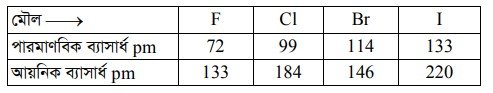
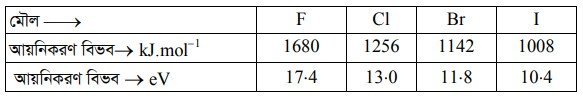
৩। আয়নিকরণ বিভব : 17 তম গ্রুপের মৌলের পরমাণুর অপেক্ষাকৃত ক্ষুদ্র আকার ও উচ্চ নিউক্লিয়াসের আধানের কারণে মৌলগুলো উচ্চ আয়নিকরণ বিভব সম্পন্ন হয়। গ্রুপ বরাবর উপর থেকে নিচের দিকে অগ্রসর হলে আয়নিকরণ বিভবের মান কমতে থাকে। এর কারণ—– (i) পরমাণুর আকারের বৃদ্ধি ও (ii) অভ্যন্তরীণ শক্তিস্তরের ইলেকট্রনগুলোর আবরণী ক্ষমতা বৃদ্ধি । F এর আয়নিকরণ বিভবের মান 1680 kJ.mol’ হলেও I এর ক্ষেত্রে এ মান 1008 kJ.mol1 হয়। আয়োডিনের কম আয়নিকরণ বিভবের কারণে এটি ইলেকট্রনকে দান করে I’ আয়নে পরিণত হয়।
৪। জারণ অবস্থা : F ভিন্ন এ গ্রুপের অন্য সব মৌল একাধিক জারণ অবস্থা প্রদর্শন করে। এতে −1, + 1, + 3, + 5, + 7 জারণ অবস্থা প্রদর্শন করে।

৫। তড়িৎ ঋণাত্মকতা : 17তম গ্রুপের মৌলের ক্ষেত্রে ক্ষুদ্র পারমাণবিক ব্যাসার্ধ ও উচ্চ নিউক্লিয়াসের আধানের জন্য এরা উচ্চ তড়িৎ ঋণাত্মকতাবিশিষ্ট হয়। এদের মধ্যে F সব থেকে বেশি তড়িৎ ঋণাত্মক। গ্রুপ বরাবর যত নিচের দিকে যাওয়া যায় মৌলের তড়িৎ ঋণাত্মকতার মান তত কমতে থাকে। ধাতব ধর্ম বাড়তে থাকে ও অধাতব ধর্ম কমতে থাকে। এ কারণে আয়োডিন কিছুটা ধাতব ধর্ম প্রদর্শন করে ।

৬। ইলেকট্রন আসক্তি : 17 তম গ্রুপের মৌলের যোজ্যতা স্তরের ইলেকট্রন বিন্যাস ns ेnp। অষ্টক পূর্ণতার জন্য আর একটি মাত্র ইলেকট্রনের প্রয়োজন। এজন্য অতি সহজেই একটি ইলেকট্রন দান করে এ পর্যায়ের পরবর্তী নিষ্ক্রিয় মৌলের ইলেকট্রন বিন্যাস প্রাপ্ত হয়। এদের ইলেকট্রন গ্রহণ করার ক্ষমতা সবচেয়ে বেশি। প্রতিটি হ্যালোজেন পরমাণুর নিউক্লিয়াসের আধানের মাত্রা বেশি হওয়ায় এরা সহজেই একটি ইলেকট্রন গ্রহণ করতে পারে। একটি মাত্র ইলেকট্রন গ্রহণের ফলেই খুব বেশি পরিমাণ শক্তি মুক্ত হয়। এ কারণে এদের ইলেকট্রন আসক্তির মান বেশি। গ্রুপ বরাবর উপর থেকে নিচের দিকে পরমাণুর আকারের বৃদ্ধির সাথে সাথে ইলেকট্রন আসক্তির মান কমে যায়।

আরও পড়ুন…

