সমযোজী বন্ধন ও এর শ্রেণিবিভাগ আমাদের আজকের আলোচনার বিষয়। এই পাঠটি “এইচএসসি রসায়ন ১ম পত্র” এর “রাসায়নিক বন্ধন” ইউনিট ৩ এর অন্তর্ভুক্ত।
Table of Contents
সমযোজী বন্ধন ও এর শ্রেণিবিভাগ
সমযোজী বন্ধন (Covalent Bond)
1916 খ্রিস্টাব্দে বিজ্ঞানী জি.এন. লুইস (G. N. Lewis) সর্বপ্রথম সমযোজী বন্ধন সম্পর্কে ধারণা দেন। তিনি প্রস্তাব করেন, মৌলের মধ্যে তড়িৎ ঋণাত্মকতা মানের পার্থক্য খুব কম বা সমান বা প্রায় সমান হলে ইলেকট্রন দান ও গ্রহণের মাধ্যমে আয়নিক বন্ধন গঠিত হয় না। তাঁর ধারণা মতে, সমান বা প্রায় সমান তড়িৎ ঋণাত্মকতা সম্পন্ন একই মৌলের দুটি পরমাণু তাদের নিজ নিজ সর্ব বহিস্থ শক্তিস্তরের সমান সংখ্যক বিজোড় ইলেকট্রন দ্বারা এক বা একাধিক ইলেকট্রন জোড়ের সৃষ্টি করে। উভয় পরমাণু দ্বারা সমভাবে ব্যবহৃত এ ইলেকট্রন জোড় বা জোড়গুলোর মাধ্যমে রাসায়নিক বন্ধন গঠিত হয়। এভাবে গঠিত রাসায়নিক বন্ধনকে সমযোজী বন্ধন বলা হয় ।
দুটি একই বা ভিন্ন মৌলের পরমাণু দুটি থেকে একটি করে মোট দুটি বিজোড় বা অযুগ্ম ও বিপরীত ঘূর্ণন-বিশিষ্ট ইলেকট্রন দ্বারা একটি সমযোজী বন্ধন গঠিত হয়। দুটি বিপরীত ঘূর্ণন বিশিষ্ট ইলেকট্রন দুটির মধ্যে সৃষ্ট তড়িৎ চুম্বকীয় আকর্ষণ বলই সমযোজী বন্ধন গঠনের ক্ষেত্রে মুখ্য ভূমিকা রাখে। উদাহরণ : A ও B মৌলের পরমাণু পরস্পরের মধ্যে দুটি ইলেকট্রন শেয়ার করে কীভাবে একটি A – B সমযোজী বন্ধন গঠন করে তা চিত্রের সাহায্যে দেখানো হলো।
A. + × B বা, A Ż B বা, A – B ( • ও × চিহ্ন-ইলেকট্রনের প্রতীক হিসাবে ধরা হয়েছে।) A মৌলের পরমাণু নিউক্লিয়াস B মৌলের পরমাণুর ইলেকট্রনকে আকর্ষণ করে। বিপরীতভাবে B মৌলের পরমাণুর নিউক্লিয়াস A মৌলের পরমাণুর ইলেকট্রনকে সমানভাবে আকর্ষণ করে। উভয় নিউক্লিয়াসের আকর্ষণ বলের প্রভাবে ইলেকট্রন দুটির একসাথে ঘূর্ণনের ফলে নিউক্লিয়াস দুটির মধ্যে মৌলের ইলেকট্রন ঘনত্বের উল্লেখযোগ্য বৃদ্ধি ঘটে। ঋণাত্মক আধানযুক্ত ইলেকট্রনের ঘনত্বের এ ধরনের বৃদ্ধি ঘটিয়ে পরমাণু দুটির মধ্যে সমযোজী বন্ধনের সৃষ্টি হয় এবং ইলেকট্রন জোড়টি A ও B পরমাণু দুটির নিউক্লিয়াসের মাঝামাঝি সুবিধাজনকভাবে অবস্থান করে।
রাসায়নিক বিক্রিয়ায় অংশগ্রহণকারী একই মৌলের পরমাণু বা ভিন্ন মৌলের পরমাণু দুটির নিজ নিজ যোজ্যতা স্তর থেকে সমানসংখ্যক বিজোড় ইলেকট্রন দ্বারা এক বা একাধিক ইলেকট্রন জোড় গঠিত হয়। এ ধরনের ইলেকট্রন জোড় পরমাণুদ্বয়ের নিউক্লিয়াস দ্বারা সমানভাবে ব্যবহৃত হয়ে পরমাণু দুটি যে রাসায়নিক বন্ধন সৃষ্টি করে তাকে সমযোজী বন্ধন বলে। যেমন— H2, N2, O2, Cl2, NH3, H2O, CH4 প্রভৃতি সমযোজী বন্ধনের মাধ্যমে গঠিত অণু ।
সমযোজী বন্ধনের প্রকারভেদ (Types of Covalent Bond)
সমযোজী বন্ধনের সংখ্যার উপর ভিত্তি করে সমযোজী বন্ধন তিন প্রকারের হয়। যথা : (i) সমযোজী একক বন্ধন, (ii) সমযোজী দ্বি- বন্ধন, (iii) সমযোজী ত্ৰি-বন্ধন ।
(i) সমযোজী একক বন্ধন : সমযোজী বন্ধনে অংশগ্রহণকারী দুটি পরমাণুর প্রত্যেকটি থেকে একটি করে ইলেকট্রন বন্ধনে অংশগ্রহণ করে একটি ইলেকট্রন জোড় সৃষ্টি করে। এ ইলেকট্রন জোড় সমযোজী একক বন্ধন গঠন করে এবং একে চিহ্ন দ্বারা প্রকাশ করা হয়।

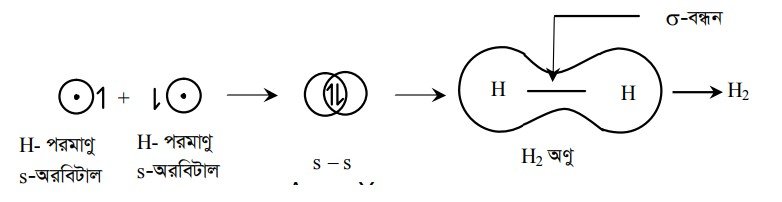
দুটি H পরমাণু তাদের 1s পারমাণবিক অরবিটালের অযুগ্ম ইলেকট্রনকে পরস্পর পরস্পরের সাথে বিপরীত স্পিনে শেয়ার করে। এ দুটি অযুগ্ম ও বিপরীত ঘূর্ণন বিশিষ্ট ইলেকট্রন দ্বারা সমযোজী একক বন্ধন গঠিত হয়।
H.+xH বা, H—H বা H2.
দুটি বিপরীত ঘূর্ণন বিশিষ্ট ইলেকট্রন দুটির মধ্যকার সৃষ্ট তড়িৎ চুম্বকীয় আকর্ষণ বলই সমযোজী একক বন্ধন গঠনে সহায়তা করে।
(ii) সমযোজী দ্বিবন্ধন : যখন বন্ধনে অংশগ্রহণকারী দুটি পরমাণুর প্রত্যেকটি থেকে দুটি করে ইলেকট্রন এনে দুটি ইলেকট্রন জোড় সৃষ্টি করে, তখন পরমাণু দুটির মধ্যে সমযোজী দ্বিবন্ধন গঠিত হয়। একে -” চিহ্ন ছাড়া প্রকাশ করা হয়। =
যেমন- O2 অণু (O = 0 ), CH2 = CH2 অণু, CO2 অণু (O=C=O) ইত্যাদি।

(i) সিগমা (c) বন্ধন ও (ii) r-বন্ধন।
১. সিগমা (c) বন্ধন : পূর্বেই উল্লেখ করা হয়েছে যে, দুটি একই বা ভিন্ন পরমাণুর দুটি পারমাণবিক অরবিটাল একই অক্ষ বরাবর মুখোমুখি অধিক্রমণের ফলে আণবিক অরবিটাল সৃষ্টির মাধ্যমে যে সমযোজী বন্ধন গঠিত হয় তাকে সিগমা (০) বন্ধন বলে । বিভিন্ন পারমাণবিক অরবিটালের অধিক্রমণের ফলে সিগমা (0) বন্ধন বিভিন্নভাবে গঠিত হতে পারে ।
(ক) s—s অধিক্রমণের মাধ্যমে : দুটি s- অরবিটালের অযুগ্ম ইলেকট্রন পরস্পর পরস্পরের সাথে অধিক্রমণের ফলে s—s o- বন্ধনের সৃষ্টি হয়। s-অরবিটালের আকৃতি গোলাকার বলে (s—s) বন্ধনে কোনো অভিমুখ গঠিত হয় না। যেমন, দুটি হাইড্রোজেন পরমাণুর প্রত্যেকের অরবিটাল একটি করে বিপরীত স্পিনযুক্ত ইলেকট্রন পরস্পরের সাথে অধিক্রমণ করে -বন্ধনের মাধ্যমে H অণু গঠন করে ।
(খ) s –p অধিক্রমণের মাধ্যমে : এক্ষেত্রে একটি $ ও একটি p-অরবিটাল পরস্পরের মুখোমুখি অধিক্রমণের ফলে ০-বন্ধন গঠিত হয়। s —p বন্ধনের নির্দিষ্ট অভিমুখ থাকে। কারণ p-অরবিটালের নির্দিষ্ট অভিমুখ আছে কিন্তু s-অরবিটাল দিক নির্দেশকহীন। এরূপ বন্ধনের অভিমুখ p-অরবিটালের অভিমুখ অনুসরণ করে উৎপন্ন হয়। s—po-বন্ধন গঠনের সময় p-অরবিটালটি অবশ্যই দিক Px নির্দেশিত অরবিটাল হতে হবে। কারণ px অরবিটালে ইলেকট্রন ঘনত্ব x-অক্ষে বরাবর নির্দেশিত থাকে। ০ বন্ধনটি প্রকৃতপক্ষে কার্যকরী হওয়ার জন্য সরলরৈখিক অধিক্রমণের (linear overlapping) জন্য এরূপ জ্যামিতিকি অবস্থান বা গঠন হয়ে থাকে।
উদাহরণস্বরূপ : HCl(g) অণুর গঠনের ক্ষেত্রে H(1) = 1s’ ।

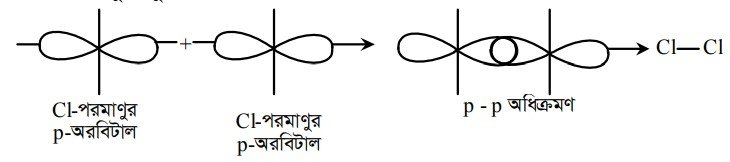
(গ) p –p অধিক্রমণের মাধ্যমে : এক্ষেত্রে দুটি p-অরবিটালের মুখোমুখি অধিক্রমণের ফলে o-বন্ধনের সৃষ্টি হয়। দুটি p-অরবিটাল সরলরৈখিক অবস্থানে মুখোমুখি অধিক্রমণ করে একটি সমযোজী সিগমা (০)-বন্ধন গঠন করে । এক্ষেত্রে অণু গঠনকারী দুটি পরমাণুর Px অরবিটালে মুখোমুখি অধিক্রমণের জন্য সাধারণত বিবেচনা করা হয়। যদি পরমাণু দুটির নিউক্লিয়াসের সংযোজক রেখাকে (molecular axis) y বা z ধরে নেওয়া হয়, তবে অধিক্রমণের জন্য পরমাণু দুটির অরবিটালদ্বয় py এবং pz বিবেচনা করা হয়। উদাহরণস্বরূপ Cl2 অণুর সৃষ্টির ক্ষেত্রে দুটি ক্লোরিন পরমাণু প্রত্যেকের 3pz-অরবিটালের বিপরীত স্পিনযুক্ত অযুগ্ম ইলেকট্রন পরস্পরের মুখোমুখি অধিক্রমণ করে ০-বন্ধন গঠন করে থাকে।
২. পাই (7) বন্ধন : দুটি পরমাণুর দুটি পারমাণবিক অরবিটালের অযুগ্ম ইলেকট্রন একই অক্ষ বরাবর পাশাপাশি অধিক্রমণের ফলে যে সমযোজী বন্ধনের সৃষ্টি হয় তাকে পাই বন্ধন বলে ।
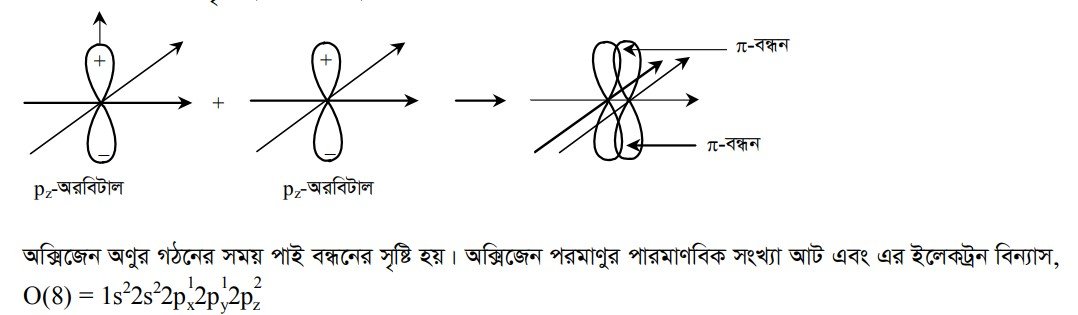
অক্সিজেন পরমাণুর যোজ্যতাস্তর ২য় শক্তিস্তরের 2px ও 2py অরবিটাল অর্ধপূর্ণ। এ দুটি অর্ধপূর্ণ p-অরবিটালের একটি 2px পারমাণবিক অরবিটালদ্বয় পরস্পর মুখোমুখিভাবে অধিক্রমণ করে সিগমা বন্ধন এবং অপর 2py খাড়াভাবে পাশাপাশি অধিক্রমণ করে পাই বন্ধনের সৃষ্টি করে ।
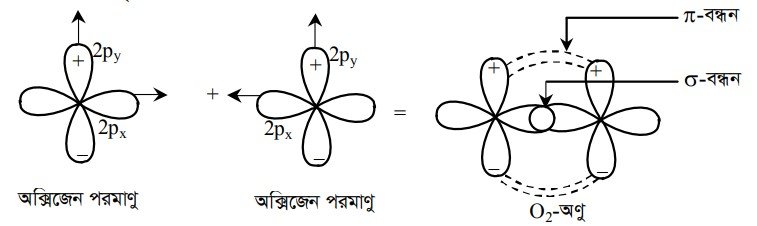
পাই বন্ধন গঠনের সময় দুটি পারমাণবিক অরবিটালের পাশাপাশি অধিক্রমণ ঘটায় অধিক্রমণ আংশিকভাবে ঘটে এবং বন্ধনটি দুর্বল হয়। প্রকৃতপক্ষে দ্বি-বন্ধন ও ত্রিবন্ধন যুক্ত যৌগে ০-বন্ধন সৃষ্টির পর r-বন্ধনের সৃষ্টি হয়। ০-বন্ধনের অনুপস্থিতিতে -বন্ধন গঠন আদৌ সম্ভব নয়। উদাহরণস্বরূপ বলা যায় O2 অণুর ন্যায় ইথিন (CH2=CH2) অণুতে কার্বন-কার্বন দ্বিবন্ধন এর মধ্যে একটি ০- বন্ধন ও একটি -বন্ধন বর্তমান। ইথাইন (CH=CH) অণুতে কার্বন-কার্বন ত্রিবন্ধন এর মধ্যে ০-বন্ধন ও দুটি -বন্ধন বর্তমান। ইথিন ও ইথাইন অণুর পূর্ণ গঠন কাঠামো পরবর্তীতে আলোচনায় অন্তর্ভুক্ত করা হয়েছে।
সমযোজী বন্ধন গঠনের শর্ত (Condition for the formation of covalent Bonds)
i. যোজ্যতা ইলেকট্রনের সংখ্যা : H-পরমাণু ব্যতীত সমযোজী বন্ধনে অংশগ্রহণকারী দুটি পরমাণুর যোজ্যতা ইলেকট্রনের সংখ্যা 4, 5, 6 বা 7 হতে হয়। যাতে প্রত্যেকটি পরমাণু 4টি, 3টি, 2টি বা 1টি ইলেকট্রন বিজোড় ইলেকট্রনকে নিয়ে অন্য পরমাণুর সাথে 4টি, 3টি, 2টি বা 1টি জোড় গঠন করে নিষ্ক্রিয় মৌলের গঠন কাঠামো সৃষ্টি করতে পারে। পর্যায় সারণির 14, 15, 16 ও 17 তম গ্রুপের অধাতব মৌলগুলো যথাক্রমে 4টি, 3টি, 2টি, 1টি ইলেকট্রন জোড় সৃষ্টি করে সমযোজী বন্ধন গঠন করে ।
ii. ইলেকট্রন আসক্তি : সমযোজী বন্ধন গঠনের ক্ষেত্রে দুটি পরমাণুর ইলেকট্রন আসক্তি সমান অথবা প্রায় সমান হওয়ার প্রয়োজন হয়। দুটি পরমাণু প্রত্যেকের ইলেকট্রনের প্রতি আকর্ষণ ক্ষমতা সমান বা প্রায় সমান হওয়া প্রয়োজন ।
iii. তড়িৎ ঋণাত্মকতা : দুটি পরমাণুর তড়িৎ ঋণাত্মকতার মান যদি সমান অথবা প্রায় সমান হয় তবে সেক্ষেত্রে কোনো একটি পরমাণু থেকে অপর পরমাণুতে ইলেকট্রনের স্থানান্তর সম্ভবপর হয় না। কেবল এ অবস্থায় পরমাণু দুটি সমযোজী বন্ধন গঠন করবে।
iv. আয়নিকরণ বিভব : বন্ধনে অংশগ্রহণকারী পরমাণু দুটির মধ্যকার প্রতিটি পরমাণুর উচ্চ আয়নিকরণ বিভব হতে হয়। উচ্চ আয়নিকরণ বিভব মান সম্পন্ন পরমাণুর ক্ষেত্রে ইলেকট্রন দান করে ক্যাটায়নে পরিণত হওয়া বেশ কঠিন হয়ে পড়ে। এ ধরনের পরমাণুগুলো যখন নিজেদের মধ্যে পরস্পরের সাথে যুক্ত হয় বা অপর একটি অধাতব মৌলের পরমাণুর সাথে যুক্ত হয় তখন কোনো অবস্থাতেই আয়নিক বন্ধন সৃষ্টি করতে পারে না। এক্ষেত্রে পরমাণুগুলো নিজেদের মধ্যে অথবা অপর অধাতব মৌলের সাথে সমযোজী বন্ধনের মাধ্যমে আবদ্ধ হয়ে অণু গঠন করে ।
v. নিউক্লিয় আধান ও নিউক্লিয়াসের মধ্যবর্তী দূরত্ব : সমযোজী বন্ধন গঠনের ক্ষেত্রে মৌলের নিউক্লিয় আধানের পরিমাণ অধিক ও নিউক্লিয়াস দুটির মধ্যকার দূরত্ব কম হতে হয়। সমযোজী বন্ধনে অংশগ্রহণকারী ইলেকট্রন জোড় নিউক্লিয়াস দুটির মধ্যবর্তী স্থানে বেশি ঘনীভূত হয়ে নিউক্লিয়াস দুটি দ্বারা সমানভাবে আকৃষ্ট হয়। নিউক্লিয়াস দুটির আধানের পরিমাণ বেশি ও এদের মধ্যকার দূরত্ব কম হলে এ আকর্ষণ বলের মান অধিক হয়। ফলে উৎপন্ন সমযোজী বন্ধন সুদৃঢ় হয়।
পোলারিটি ও পোলারায়ন (Polarity and Polarization)
পোলারিটি : সমযোজী বন্ধনে অংশগ্রহণকারী পরমাণুসমূহ একটি করে ইলেকট্রন শেয়ার করে বন্ধন গঠন করে। এক্ষেত্রে উভয় পরমাণুর শেয়ারকৃত ইলেকট্রন পরমাণুদ্বয়ের মাঝখানে অবস্থান করে। যদি উভয় পরমাণুর তড়িৎ ঋণাত্মকতার মান একই হয় তবে উভয় পরমাণুর নিউক্লিয়াস কর্তৃক শেয়ারকৃত ইলেকট্রনের উপর আকর্ষণ বল সমান হবে তাই ইলেকট্রন জোড় উভয় পরমাণু হতে একই নির্দিষ্ট দূরত্বে অবস্থান করবে।
কিন্তু যদি বন্ধনে অংশগ্রহণকারী পরমাণুদ্বয়ের মধ্যে তড়িৎ ঋনাত্মকতার পার্থক্য হয় (যেমন— HF অণুর ক্ষেত্রে H = 2.1 এবং F 4.0) তবে শেয়ারকৃত ইলেকট্রন যুগলের উপর তীব্র তড়িৎ ঋণাত্মক পরমাণু অপেক্ষা কম = তড়িৎ ঋণাত্মক পরমাণুর আকর্ষণ বলের মান কম হয় ফলে শেয়ারকৃত ইলেকট্রন যুগল তীব্র তড়িৎ ঋণাত্মক পরমাণুর দিকে সরে যায়। এ কারণে তীব্র তড়িৎ ঋণাত্মক পরমাণুতে আংশিক ঋণাত্মক চার্জ এবং কম তড়িৎ ঋণাত্মক পরমাণুতে আংশিক ধনাত্মক চার্জের সৃষ্টি হয়। অণুর দুই প্রান্তে ঋণাত্মক এবং ধনাত্মক চার্জ সৃষ্টি হওয়াকে এক্ষেত্রে ডাইপোল (dipole) বলে । কোনো সমযোজী যৌগের অণুতে ডাইপোল সৃষ্টির ধর্মকে ঐ যৌগের পোলারিটি (Polarity) বলে। নিম্নে HF অণুতে ডাইপোল দেখানো হলো :
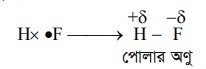
সমযোজী বন্ধনে অংশগ্রহণকারী দুটি পরমাণুর তড়িৎ ঋণাত্মকতার পার্থক্য যত বেশি হবে ঐ যৌগের পোলারিটি তত বেশি হবে। কোনো যৌগের পোলারিটি যত বেশি হবে ঐ যৌগের আয়নিক বৈশিষ্ট্য তত বৃদ্ধি পায়। পউলিং স্কেল অনুসারে কয়েকটি মৌলের তড়িৎ ঋণাত্মকতার মান নিম্নে দেয়া হলো :
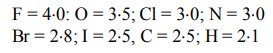
পোলারায়ন বা আয়নের বিকৃতি (Polarization) : যখন কোনো ধাতব পরমাণু এবং অধাতব পরমাণুর মধ্যে বন্ধন গঠিত হয় তখন ধাতব পরমাণু ইলেকট্রন ত্যাগ করে এবং অধাতব পরমাণু সেই ইলেকট্রন গ্রহণ করে নিকটতম নিষ্ক্রিয় গ্যাসের কাঠামো অর্জন করে । ইলেকট্রন ত্যাগ করার ফলে ধাতব পরমাণু ধনাত্মক চার্জযুক্ত ক্যাটায়নে পরিণত হয় এবং অধাতব পরমাণু ইলেকট্রন গ্রহণ করে ঋণাত্মক আয়ন বা অ্যানায়নে পরিণত হয়। পরবর্তীতে ক্যাটায়ন এবং অ্যানায়ন ইলেকট্রোস্ট্যাটিক আকর্ষণ বলের মাধ্যমে যুক্ত হয়ে আয়নিক বন্ধন গঠন করে।
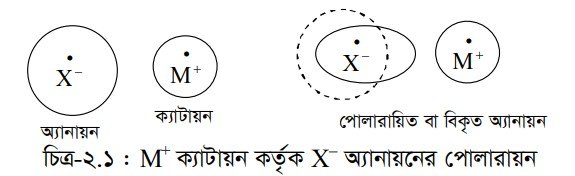
আয়নিক বন্ধন গঠনের সময় কোনো ক্যাটায়ন যখন কোনো অ্যানায়নের খুব নিকটে আসে তখন ক্যাটায়নের নিউক্লিয়াসের ধনাত্মক চার্জ দ্বারা অ্যানায়নের ইলেকট্রন মেঘকে নিজের দিকে আকর্ষণ করে, একই সাথে ক্যাটায়নের নিউক্লিয়াস কর্তৃক অ্যানায়নের নিউক্লিয়াসকে বিকর্ষণ করে। এ আকর্ষণ এবং বিকর্ষণ বলের সম্মিলিত প্রভাবে উভয় পরমাণু নির্দিষ্ট দূরত্বে অবস্থান করে কিন্তু অ্যানায়নের ইলেকট্রন মেঘ ক্যাটায়নের দিকে সরে আসে, একে ক্যাটায়ন দ্বারা অ্যানায়নের বিকৃতি বা পোলারায়ন বলে। এক্ষেত্রে অ্যানায়নটি পোলারায়িত হয়েছে বলা হয়। ক্যাটায়ন দ্বারা এভাবে অ্যানায়নের পোলারায়িত হওয়ার ক্ষমতাকে ক্যাটায়নের পোলারায়ন ক্ষমতা বলে ।
আরও পড়ুন…

